
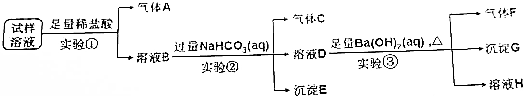
分析 (1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为二氧化碳或NO,由于盐酸过量且溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、NO3-、Cl-,且NO3-过量;根据离子共存可知一定不存在CO32-;
(2)硝酸根离子在酸性条件下具有强氧化性,能够将亚铁离子氧化成铁离子,同时生成NO气体,据此写出反应的离子方程式;
(3)实验①中盐酸足量,则溶液B中含有过量的氢离子,加入碳酸氢钠后发生反应为:H++HCO3-=H2O+CO2↑;溶液B中还含有Fe3+,当氢离子反应完全后,铁离子与碳酸氢根离子发生双水解反应生成氢氧化铁沉淀和二氧化碳气体;
当Fe3+-完全反应时,其离子浓度小于1×10-5mol•L-1,根据KsP[Fe(OH)3]=4.0×10-38=c(Fe3+)•c3(OH-)列式计算;
(4)溶液D中加入氢氧化钡溶液加热后生成气体F、沉淀G和溶液H,气体F为氨气,由于碳酸氢钠过量,则沉淀G中一定含有碳酸钡,可能含有硫酸钡;
(5)由于碳酸氢钠过量,则生成的沉淀中不一定含有硫酸钡,需要通过对沉淀G进一步检验,可向沉淀G中加入稀硝酸,若沉淀部分溶解,则说明原溶液中一定含有了酸根离子.
解答 解:(1)实验①中加入稀盐酸后,有无色气体A生成,该气体可能为CO2或NO,由于盐酸过量且反应后溶液中阴离子种类不变,则生成的气体为NO,溶液中一定含有Fe2+、Cl-、NO3-,且NO3-过量;根据离子共存可知一定不存在CO32-,
故答案为:Fe2+、Cl-、NO3-;CO32-;
(2)实验①中亚铁离子与稀硝酸反应生成硝酸铁和一氧化氮和水,反应的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)实验①加入足量盐酸,则溶液B中含有过量的氢离子,加入碳酸氢钠后发生反应的离子方程式为:H++HCO3-=H2O+CO2↑;溶液B中还含有Fe3+,氢离子反应完全后,铁离子与碳酸氢根离子发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;当Fe3+-完全反应时,其离子浓度小于1×10-5mol•L-1,根据KsP[Fe(OH)3]=4.0×10-38=c(Fe3+)•c3(OH-)可得:c(OH-)=$\root{3}{\frac{4×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=$\root{3}{4}$×10-11mol/L,溶液中氢离子浓度:$\frac{1×1{0}^{-14}}{\root{3}{4}×1{0}^{-11}}$mol/L=$\frac{1×1{0}^{-3}}{\root{3}{4}}$,则此时溶液的pH=-lg$\frac{1×1{0}^{-3}}{\root{3}{4}}$=3+lg$\root{3}{4}$=3+$\frac{2}{3}$lg2=3.2,
故答案为:H++HCO3-=H2O+CO2↑;Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;3.2;
(4)溶液D中加入足量Ba(OH)2溶液加热后生成气体F、沉淀G和溶液H,气体F为NH3,由于实验②中NaHCO3足量,则沉淀G中一定含有BaCO3,可能含有BaSO4,
故答案为:NH3;
(5)由于实验②中NaHCO3足量,则实验③的沉淀G中一定含有沉淀BaCO3,不能确定是否含有BaSO4,需要进行后续实验④,可向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-,
答:向沉淀G中加入足量的稀硝酸,若沉淀部分溶解,则证明原溶液中含有SO42-.
点评 本题考查了化学实验基本操作方法及其综合应用,题目难度中等,涉及离子推断、难溶物溶度积的计算、离子方程式书写、常见离子的检验等知识,明确常见化学实验基本操作方法为解答关键,试题知识点较多、综合性及其,充分考查了学生的灵活应用能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水、高锰酸钾溶液褪色 | |
| B. | 碘片、氯化铵晶体受热消失 | |
| C. | 二氧化硫和氯气使品红溶液褪色 | |
| D. | 乙醛、葡萄糖与银氨溶液水浴加热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子电子层结构为1s22s1 | B. | Y为ⅡA族元素,其元素符号为Mg | ||
| C. | Z的价电子数为1 | D. | X的原子半径小于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A. | pH:Na2CO3溶液小于Na2SO3溶液 | |
| B. | 结合H+能力:CO32-弱于SO32- | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | ①与②溶液等体积混合后的溶液中:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向两种气体中加入适量水,震荡 | B. | 将两种气体分别通入AgNO3溶液中 | ||
| C. | 用湿润的淀粉KI试纸检验 | D. | 将两种气体加压、冷却 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com