
分析 (1)根据蓝色氧化钨中钨的质量分数为0.7985来计算求出a;
(2)把五价和六价两种价态的氧化物的化学式分别写成WO2.5和WO3,设蓝色氧化钨的组成为xWO2.5•yWO3,利用W和O的个数之比为1:2.90来解答;
(3)若反应前空气为100L,氧气只20L,由4FeWO4+4Na2CO3+O2$\stackrel{△}{→}$4Na2WO4+2Fe2O3+4CO2 生成二氧化碳为80L;
(4)4FeWO4+4 Na2CO3+O2═4 Na2WO4+2Fe2O3+4CO2 气体增加 ①
x 4x 4x 3x
2MnWO4+2Na2CO3+O2═2 Na2WO4+2MnO2+2CO2 气体增加 ②
y 2y 2y y
而每反应1mol O2时,气体就增加1.5mol,由此分析解答;
(5)水的质量为:1000×1.19×0.63=749.7g,生成NaCl为6.030×2×58.5=705.51g;749.7水可溶解NaCl为749.7×0.36=269.90 g,因为是饱和溶液,所以溶液中NaCl的质量分数为=$\frac{36}{136}×100%$.
解答 解:(1)WOa中钨的质量分数为$\frac{183.84}{183.84+16×a}$=0.7985,解得a=2.90;
故答案为:2.90;
(2)把五价和六价两种价态的氧化物的化学式分别写成WO2.5和WO3,设蓝色氧化钨的组成为xWO2.5•yWO3,
因W和O的个数之比为1:2.90,则有$\frac{x+y}{2.5x+3y}=\frac{1}{2.9}$,解得$\frac{x}{y}=\frac{1}{4}$,所以蓝色氧化钨中五价和六价两种价态的钨的原子数之比为:1:4,故答案为:1:4;
(3)若反应前空气为100L,氧气只20L,由4FeWO4+4Na2CO3+O2$\stackrel{△}{→}$4Na2WO4+2Fe2O3+4CO2 生成二氧化碳为80L,所以反应后所得气体中CO2的体积分数为$\frac{80}{160}$×100%=50%,故答案为:50%;
(4)4FeWO4+4 Na2CO3+O2═4 Na2WO4+2Fe2O3+4CO2 气体增加 ①
x 4x 4x 3x
2MnWO4+2Na2CO3+O2═2 Na2WO4+2MnO2+2CO2 气体增加 ②
y 2y 2y y
而每反应1mol O2时,气体就增加1.5mol,所以$\left\{\begin{array}{l}{x+y=1}\\{3x+y=1.5}\end{array}\right.$,解之得:$\left\{\begin{array}{l}{x=0.25}\\{y=0.75}\end{array}\right.$,生成物中Fe2O3与MnO2的物质的量之比为1:3,
则Na2WO4为$\frac{4x+2y}{1.5}×300$=500 mol,故答案为:1:3;500 mol;
(5)水的质量为:1000×1.19×0.63=749.7g,生成NaCl为6.030×2×58.5=705.51g;749.7水可溶解NaCl为749.7×0.36=269.90 g,因为是饱和溶液,所以溶液中NaCl的质量分数为=$\frac{36}{136}×100%$=26.47%,答:该溶液中NaCl的质量分数26.47%.
点评 本题考查根据方程式的计算,题目计算量较大,过程复杂,为易错题目,注意利用关系式与原子守恒进行的解答,难度较大.


科目:高中化学 来源: 题型:解答题
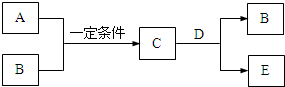 A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:
A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该分子中存在肽键 | |
| B. | 最多可以有12个碳原子共平面 | |
| C. | 1 mol氯雷他定最多可与8 mol氢气发生加成反应 | |
| D. | 能与NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
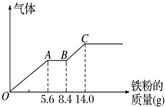 硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com