
【题目】4.35克二氧化锰与50mL12mol/L浓盐酸反应生成标准状况下氯气______升?将反应后所得的溶液稀释至1L,从中取出25mL,加足量的硝酸银溶液,可得沉淀_______克?(MnO2+4HCl![]() MnCl2++Cl2↑+2H2O)
MnCl2++Cl2↑+2H2O)
【答案】1.12 1.79
【解析】
二氧化锰的物质的量是n=![]() =
=![]() =0.05mol
=0.05mol
浓盐酸中氯化氢的物质的量是n=cV=12molL×0.05L=0.6mol
氯化氢远远过量,二氧化锰能完全反应。(注意这个反应应该是浓盐酸才反应,要是盐酸不足或者不是过量很多,随着反应盐酸越来越稀,反应会停止)
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87 22.4L
4.35g V
列比例式解得V=1.12L,即生成氯气1.12升。
反应生成1.12L氯气,其物质的量是0.05mol,里面含有的氯原子是0.1mol。开始的时候加入的盐酸中含有氯离子0.6mol,反应后有0.1mol氯原子生成氯气,脱离溶液。所以反应完之后,溶液中含有氯离子的物质的量=0.6mol -0.1mol =0.5mol,将反应后所得的溶液稀释至1L,所得的溶液中氯离子的物质的量仍为0.5mol,从中取出25mL,25mL溶液中氯离子的物质的量= 0.5mol×![]() =0.0125mol,加足量的硝酸银溶液,可得氯化银沉淀0.0125mol,质量是:m=n·M=0.0125mol×143.5g/mol=1.79g,
=0.0125mol,加足量的硝酸银溶液,可得氯化银沉淀0.0125mol,质量是:m=n·M=0.0125mol×143.5g/mol=1.79g,
答案为:1.12;1.79。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(4)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,且离子具有相同的电子层结构。X的一种单质可杀菌消毒。W原子的最外层电子数与最内层电子数相等。下列说法不正确的是
A. 原子半径r(Z)>r(W)>r(X)>r(Y)
B. X的简单氢化物热稳定性比Y的强
C. 四种元素常见单质中,Y2的氧化性最强
D. X能与Z形成Z2X2,该化合物中含离子健和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有甲、乙两份体积为1 L,浓度均为0.1 mol/L的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2mol/L的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为( )
A. 3;0.1 B. 5;0. 2 C. 3<x<5;0.1 D. 3<x<5;0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热可以制取Fe(OH)3胶体。试回答下列问题:
①写出此过程中的化学方程式:__;
②向所得Fe(OH)3胶体中逐滴滴加硫酸溶液,开始产生红褐色沉淀,继续滴加,沉淀最终消失且得棕黄色溶液,写出相关的离子方程式___;
(2)鸡蛋的内膜是一种半透膜,某同学拟用这种半透膜进行除去淀粉溶液中所含食盐的实验。设计步骤如下:
a.把鸡蛋的一头敲破,倒出蛋清、蛋黄,洗净蛋膜内部,将另一头浸泡在稀酸中溶去部分蛋壳(中间的蛋壳留着,起固定作用);
b.在一只小烧杯中加入适量蒸馏水,将洗净了蛋膜外部的蛋壳架在小烧杯上,蛋膜浸入蒸馏水中(如图);
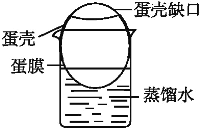
c.向蛋膜内加入淀粉和食盐的混合溶液,静置一段时间;
d.拿走蛋膜,检验烧杯中有无淀粉和食盐。
根据以上叙述,回答下列问题:
①步骤a中溶解蛋壳(主要成分为CaCO3)的酸最好是_____(填“盐酸”“硫酸”或“醋酸”)。
②检验烧杯中有无淀粉,操作是_____,检验烧杯中有无NaCl,操作是_____。
③为尽可能除去淀粉溶液里的食盐,可采取的措施是______(填入正确选项前的字母)。
A.换大烧杯,用大量水进行渗析
B.多次渗析,每次用水量不要太多
C.将蛋膜放在有流水的水槽中进行渗析
④如何证明淀粉溶液中的食盐有没有全部除去?简述实验过程:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
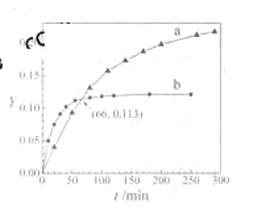
A. b代表![]() 下CH3COCH3的Y-t曲线
下CH3COCH3的Y-t曲线
B. 反应进行到20min末,H3COCH3的![]()
C. 升高温度可缩短反应达平衡的时间并能提高平衡转化率
D. 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究水样中污染物X在不同影响因素下的分解速率,测得X的物质的量浓度(![]() )随时间(min)变化的实验数据如下:
)随时间(min)变化的实验数据如下:
温度 | 时间 浓度 水样 | 0 | 10 | 20 | 30 | 40 |
| I | 0.80 | 0.68 | 0.60 | 0.56 | 0.54 |
| II | 1.60 | 1.34 | 1.20 | 1.08 | 1.02 |
| III | 1.60 | 1.26 | 1.08 | 0.94 | 0.94 |
下列说法不正确的是
A. ![]() 温度下水样I中,
温度下水样I中,![]() 之间X分解的平均反应速率为
之间X分解的平均反应速率为![]()
B. ![]() 温度下水样Ⅱ中,
温度下水样Ⅱ中,![]() 时X的浓度小于
时X的浓度小于![]()
C. ![]() 温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为
温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为![]()
D. 由表中数据推测,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图:
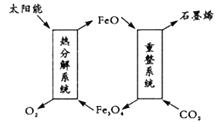
则重整系统发生反应的化学方程式为_________。
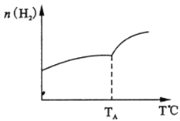
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将________(填“增大”、“ 减小”或“不变”);
②△H_____0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 _____H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) △H1=akJ/mol
NH4+(aq)+OH-(aq) △H1=akJ/mol
CO2(g)+H2O(l)![]() H2CO3(aq) △H2=bkJ/mol
H2CO3(aq) △H2=bkJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq)+H2O(l) △H3=ckJ/mol
HCO3-(aq)+H2O(l) △H3=ckJ/mol
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为______________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5kJ/mol |
Ka1(H2CO3) | 4×10-7kJ/mol |
Ka2(H2CO3) | 4×10-11kJ/mol |
则反应NH4++HCO3-+H2O![]() NH3 H2O+H2CO3的平衡常数K=___________。
NH3 H2O+H2CO3的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做l题。若两题都作答,则以A题计分。
A《化学与生活》
(1)防治环境污染、改善生态环境已成为全人类的共识。
①下列各项中,完成空气质量报告时不需要监测的是______(填字母)。
a.二氧化碳的浓度 b.二氧化硫的浓度 c.可吸入颗粒物的浓度
②下列做法中不利于改善环境质量的是______(填字母)。
a.将废旧电池进行深埋处理
b.充分利用风能等新能源
c.给汽车加装尾气催化净化装置
③工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是______(填字母)。
a.氧化还原法 b.中和法 c.沉淀法
④煤炭直接燃烧引起多种环境问题。燃煤产生的SO2增加了______形成的可能;处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为_____________________。
(2)合理应用化学知识可以更好地认识生活、改善生活。
①等质量的糖类、油脂、蛋白质中,提供能量最多的是______。蛋白质水解可以得到______。
②人体牙龈出血、患坏血病的原因主要是因为缺乏______(填“维生素A”、“维生素C”或“维生素D”)。
(3)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题:

①石墨烯(见图)可用作太阳能电池的电极,这里主要利用了石墨烯的______性。
②高炉炼铁和生产硅酸盐水泥都要用到的原料是______(填字母)。
a. 黏土 b. 石灰石 c. 焦炭
③“神七”国产“飞天”舱外服由六层组成。从内到外依次为由特殊防静电处理过的棉布组成的舒适层、合成橡胶质地的备份气密层、复合材料结构组成的主气密层、涤纶面料的限制层、隔热层和最外防护层。其中由天然有机高分子材料组成的层是______(填字母)。
a. 舒适层 b. 备份气密层 c. 主气密层
④材料与化学密切相关,表中对应关系正确的是______(填字母)。
选项 | 材料 | 主要化学成分 |
a | 刚玉、金刚石 | 三氧化二铝 |
b | 大理石、石灰石 | 碳酸钙 |
c | 光导纤维、普通玻璃 | 硅酸盐 |
⑤铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用盐酸除去,写出该反应的化学方程式________________________________。
B《有机化学基础》
(1)认识有机化合物的结构与类别有助于理解其性质。
①下列有机化合物与苯甲酸(C6H5COOH)互为同系物的是______(填字母,下同)。
a. C6H5CH2COOH b. C6H5CH2CHO c. C6H5OH
②下列有机化合物易溶于水的是______。
a. 苯 b. 乙烷 c. 乙醇
③下列试剂可用于鉴别乙酸和乙醛的是______。
a. 水 b. 银氨溶液 c. 稀硫酸
(2)扁桃酸(C6H5CHOHCOOH)是一种重要的化工原料。
①扁桃酸分子中有______种不同化学环境的氢。
②扁桃酸中含氧官能团的名称为______和______。
③1 mol扁桃酸最多能与______mol金属钠反应
(3)化合物C是一种医药中间体,可通过下列方法合成:
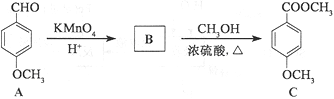
①A中含氧官能团的名称为______和______。
②B的结构简式为______。
③B→C的反应类型为______。
④C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应,且1molD最多能与2molNaOH反应。D分子中有4种不同化学环境的氢,请写出D的一种结构简式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com