
【题目】常温下,有甲、乙两份体积为1 L,浓度均为0.1 mol/L的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2mol/L的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为( )
A. 3;0.1 B. 5;0. 2 C. 3<x<5;0.1 D. 3<x<5;0.2
【答案】D
【解析】
醋酸为弱电解质,加水稀释促进电离,0.1mol/L的醋酸用蒸馏水稀释100倍后,溶液的3<pH<5,与等体积、浓度为0.2mol/L的NaOH混合,可从电荷守恒的角度分析。
醋酸为弱电解质,在溶液中存在醋酸的电离平衡CH3COOH![]() CH3COO-+H+,加水稀释促进电离,0.1mol/L的醋酸用蒸馏水稀释100倍后,溶液的3<pH<5,与等体积、浓度为0.2mol/L的NaOH混合,根据电荷守恒可知:n(Na+)+n(H+)=n(OH-)+n(CH3COO-),则n(CH3COO-)+ n(OH-)- n(H+)= n(Na+)=ymol, n(Na+)=0.2mol/L×1L=0.2mol,所以y=0.2,故合理选项是D。
CH3COO-+H+,加水稀释促进电离,0.1mol/L的醋酸用蒸馏水稀释100倍后,溶液的3<pH<5,与等体积、浓度为0.2mol/L的NaOH混合,根据电荷守恒可知:n(Na+)+n(H+)=n(OH-)+n(CH3COO-),则n(CH3COO-)+ n(OH-)- n(H+)= n(Na+)=ymol, n(Na+)=0.2mol/L×1L=0.2mol,所以y=0.2,故合理选项是D。


科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:





(1)该反应中生成氯气的化学方程式为:____________________________________________
(2)连接上述仪器的正确顺序是(填各接口处的字母),________接________,________接__________接_________,_________接______________
(3)在装置中,①饱和食盐水起的作用是__________________________________
②浓硫酸起的作用是______________________________________________
③NaOH溶液的作用是_____________________________________________
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是_______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普洱茶具有独特的香气,是云南的旅游名片之一。橙花叔醇是影响其香气的物质之一,结构如图所示。下列说法正确的是
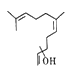
A. 该物质的化学式是C15H26O
B. 该物质不能使酸性高锰酸钾溶液褪色
C. 该物质的同分异构体可以是芳香族化合物
D. 该物质可以发生加成反应,不能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用0.2000mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O42H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0g草酸晶体,配成250.00mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00mL放入锥形瓶中,用0.2000mol/L的酸性KMnO4溶液滴定.
①量取25.00mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .
![]()
(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列方程式:
(1)电离方程式
①Al2(SO4)3__________;
②NH3·H2O_____;
③BaSO4_____;
④NaHSO4(水溶液)______;
⑤H2S______;
(2)离子方程式
①碳酸氢钠溶液和氢氧化钠溶液反应__。
②用稀硫酸清洗铁锈__。
③向足量澄清石灰水中通入二氧化碳___。
④硫酸与氢氧化钡溶液反应___。
⑤碳酸氢钠溶液与少量的氢氧化钙溶液反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.35克二氧化锰与50mL12mol/L浓盐酸反应生成标准状况下氯气______升?将反应后所得的溶液稀释至1L,从中取出25mL,加足量的硝酸银溶液,可得沉淀_______克?(MnO2+4HCl![]() MnCl2++Cl2↑+2H2O)
MnCl2++Cl2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氯气通入含Fe2+、I-、Br-的溶液,溶液中四种粒子的物质的量的变化如图所示。已知b=a+5,线段Ⅳ表示一种含氧酸,且线段I和Ⅳ表示的物质中含有相同的元素。下列说法错误的是

A. 线段I表示I-的变化情况
B. a点时消耗Cl2的体积为134.4 L
C. 原溶液中n(Fe2+):n(Br-) =2:3
D. 线段Ⅳ表明氧化性:C12>HIO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com