
【题目】写出下列方程式:
(1)电离方程式
①Al2(SO4)3__________;
②NH3·H2O_____;
③BaSO4_____;
④NaHSO4(水溶液)______;
⑤H2S______;
(2)离子方程式
①碳酸氢钠溶液和氢氧化钠溶液反应__。
②用稀硫酸清洗铁锈__。
③向足量澄清石灰水中通入二氧化碳___。
④硫酸与氢氧化钡溶液反应___。
⑤碳酸氢钠溶液与少量的氢氧化钙溶液反应___。
【答案】Al2(SO4)3=2Al3++3SO42- NH3·H2O![]() NH4++OH- BaSO4(熔融)=Ba2++SO42- NaHSO4=Na++H++SO42- H2S
NH4++OH- BaSO4(熔融)=Ba2++SO42- NaHSO4=Na++H++SO42- H2S![]() H++ HS- HCO3-+OH-=CO32-+H2O 6H++Fe2O3=2Fe3++3H2O Ca2++2OH-+CO2=CaCO3↓+H2O 2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O 2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
H++ HS- HCO3-+OH-=CO32-+H2O 6H++Fe2O3=2Fe3++3H2O Ca2++2OH-+CO2=CaCO3↓+H2O 2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O 2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
【解析】
(1)①Al2(SO4)3为强电解质,完全电离:Al2(SO4)3=2Al3++3SO42-,
答案为:Al2(SO4)3=2Al3++ 3SO42-;
②NH3·H2O 是弱电解质,部分电离:NH3·H2O![]() NH4++OH-,
NH4++OH-,
答案为:NH3·H2O![]() NH4++OH-
NH4++OH-
③BaSO4是强电解质,熔融状态下可完全电离:BaSO4(熔融)=Ba2++ SO42-,
答案为:BaSO4(熔融)=Ba2++ SO42-;
④NaHSO4是强电解质,在水中完全电离:NaHSO4=Na++H++ SO42-,
答案为:NaHSO4=Na++H++ SO42-;
⑤H2S是弱电解质,在水溶液中部分电离:H2S![]() H++ HS-,
H++ HS-,
答案为:H2S![]() H++ HS-;
H++ HS-;
(2)①碳酸氢钠溶液和氢氧化钠溶液反应生成碳酸钠和水,离子反应方程式为HCO3-+OH-=CO32-+H2O,
答案为:HCO3-+OH-=CO32-+H2O;
②稀硫酸与氧化铁反应生成硫酸铁和水,离子反应方程式为6H++Fe2O3=2Fe3++3H2O,
答案为:6H++Fe2O3=2Fe3++3H2O;
③向足量澄清石灰水中通入二氧化碳生成碳酸钙和水,离子反应方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,
答案为:Ca2++2OH-+CO
④硫酸与氢氧化钡溶液反应生成硫酸钡和水,离子反应方程式为2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O,
答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
⑤碳酸氢钠溶液与少量的氢氧化钙溶液反应生成碳酸钙、碳酸钠和水,离子反应方程式为2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,
答案为:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知气相直接水合法制取乙醇的反应为H2O(g)+C2H4(g)![]() CH3CH2OH(g)。在容积为3L的密闭容器中,当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图所示:
CH3CH2OH(g)。在容积为3L的密闭容器中,当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图所示:

下列说法正确的是
A. a、b两点平衡常数:b>a
B. 压强大小顺序: P1>P2>P3
C. 当混合气的密度不变时反应达到了平衡
D. 其他条件不变,增大起始投料![]() ,可提高乙烯转化率
,可提高乙烯转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是__________________。
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

该工艺中可循环使用的物质有______________。
(3)储氢材料Mg(AlH4)2在110~200 ℃的反应为Mg(AlH4)2=MgH2+2Al+3H2↑,每转移6 mol电子生成氢气的物质的量为________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.100 0 g产品用适量硝酸溶解,经稀释等步骤最终配得500 mL的溶液。
a.准确量取25.00 mL 待测液,用0.100 0 mol/L AgNO3标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为________mL。

b.
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
①CaCl2 ②NaBr ③NaI ④K2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向电解质溶液中加入新物质时,其导电性符合图示变化趋势的实验操作是
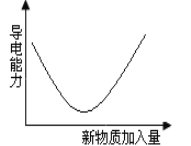
A.NaOH溶液中通入Cl2 至过量
B.硫酸镁溶液中加入Ba(OH)2溶液至过量
C.氨水中加醋酸溶液至过量
D.氯化钠固体加入氯化钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有甲、乙两份体积为1 L,浓度均为0.1 mol/L的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x;②乙与等体积、浓度为0.2mol/L的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol,x、y的正确答案组合为( )
A. 3;0.1 B. 5;0. 2 C. 3<x<5;0.1 D. 3<x<5;0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学类比镁在二氧化碳中的燃烧反应:2Mg+CO2=2MgO+C,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。
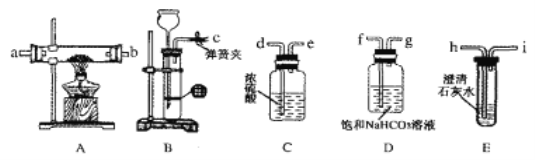
依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置中的__(填装置下方对应字母),反应的离子方程式为___。
(2)为达到实脸目的,选择上图中的装置,其连接顺序为:二氧化碳的发生装置→___。(按气流方向,用小写字母表示)。
(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。能说明装置中空气已经排净的现象是___。
(4)若反应过程中CO2足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为Na2CO3,②生成的固体物质为Na2CO3和C的混合物,③生成的固体物质为Na2CO3和Na2O的混合物,④生成的固体物质为Na2O和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是___;则钠与CO2反应的化学方程式为___。
(5)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,PdCl2溶液可以吸收CO,同时得到黑色的Pd。于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
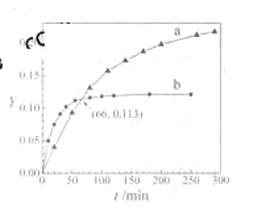
A. b代表![]() 下CH3COCH3的Y-t曲线
下CH3COCH3的Y-t曲线
B. 反应进行到20min末,H3COCH3的![]()
C. 升高温度可缩短反应达平衡的时间并能提高平衡转化率
D. 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是______(填字母)。
a.植树造林,保护森林,保护植被
b.加大对煤和石油的开采,并鼓励使用液化石油气
c.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发
d.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:CO2+4H2![]() _____+2H2O。
_____+2H2O。
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2molCO2和6molH2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=___。
CH3OH(g)+H2O(g)。现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=___。
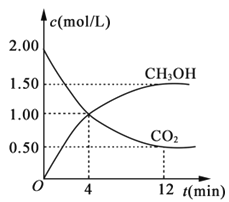
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。通入甲醇的电极为燃料电池的______(填“正”或“负”)极,正极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350 ℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如下:
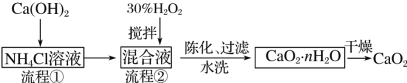
(1)搅拌的目的是______。流程②中没有采用加热措施的可能原因是______、______。流程②的化学反应方程式为________________。
(2)整个流程中,除水外还可以循环使用的物质是______。
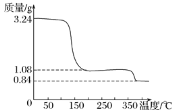
(3)取上述制得的CaO2·nH2O晶体进行热重分析,其热分解时晶体的质量随温度变化的曲线如右图。请通过计算给出过氧化钙晶体(CaO2·nH2O)的化学式(写出计算过程) __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com