
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2设计从孔雀石中冶炼铜的方案如下:
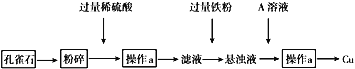
(1)将孔雀石粉碎的目的是_______,加入过量稀硫酸,可观察到的现象是_______
(2)操作a的名称是_______,在滤液中加入过量铁粉发生的反应有___________(用离子方程式表示)
(3)在悬浊液中加入A的目的是______________
【答案】增大接触面积,加快反应速率(或提高原料的浸出率) 固体溶解,生成蓝色溶液和无色气体 过滤 Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑ 除去未反应的铁
【解析】
(1)将孔雀石粉碎的目的是增大接触面积,加快反应速率(或提高原料的浸出率),加入过量稀硫酸,发生的反应为:CuCO3·Cu(OH)2+2H2SO4=2CuSO4+3H2O+CO2↑,可观察到的现象是固体溶解,生成蓝色溶液和无色气体,答案为:增大接触面积,加快反应速率(或提高原料的浸出率);固体溶解,生成蓝色溶液和无色气体;
(2)操作a用于分离固液混合物,所以应为过滤;在滤液中加入过量铁粉,发生的反应为:Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑;答案为过滤;Fe+Cu2+=Fe2++Cu,Fe+2H+=Fe2++H2↑;
(3)悬浊液为铁粉、铜粉和硫酸亚铁的混合液,过滤出的固体铜中会混有铁,所以应加入硫酸溶解,从而得出加入A的目的是除去未反应的铁,答案为:除去未反应的铁。


科目:高中化学 来源: 题型:
【题目】生物材料衍生物2,5-呋喃二甲酸(![]() )可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
)可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
A. 合成PEF的反应为加聚反应
B. PEF不能与氢气发生加成反应
C. 通过红外光谱法测定PEF的平均相对分子质量,可得其聚合度
D. 聚对苯二甲酸乙二醇酯的结构简式为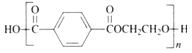
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
②H2(g)+![]() O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
③C(s)+![]() O2(g)═CO(g) △H=﹣110.5kJmol﹣1
O2(g)═CO(g) △H=﹣110.5kJmol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJmol﹣1
回答下列各问题:
(1)上述反应中属于放热反应的是___。
(2)H2的燃烧热为___;C的燃烧热为___。
(3)燃烧10gH2生成液态水,放出的热量为___。
(4)CO燃烧的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照如图所示的操作步骤,完成铝与盐酸反应的实验。
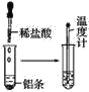
回答下列问题:
(1)实验过程中观察到的实验现象是__。
(2)写出铝与盐酸反应的离子方程式__。
(3)该反应是放热反应还是吸热反应__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为验证SO2的性质设计如图所示的实验装置,下列说法错误的是( )
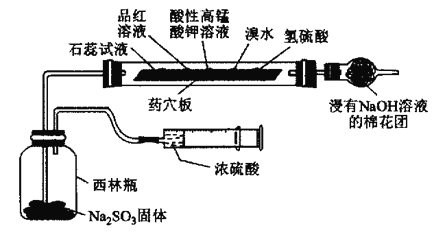
A.一段时间后石蕊溶液和品红溶液均褪色,说明SO2有漂白性
B.一段时间后酸性高锰酸钾溶液、溴水褪色,说明SO2有还原性
C.一段时间后氢硫酸溶液中有淡黄色沉淀生成,说明SO2有氧化性
D.该装置能体现实验的微型化和绿色化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
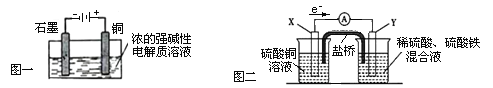
A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com