
【题目】下列事实中,可以证明A12O3中一定存在离子键的是( )
A. 水溶液能导电 B. 有较高的熔点 C. 熔化时能导电 D. 易溶于水
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
实验装置与现象 | |||
装置 | 甲 | 乙 | 丙 |
|
|
| |
现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
A. 装置甲中的B金属是原电池的负极
B. 装置乙中的C金属是原电池的阴极
C. 装置丙中的D金属是原电池的正极
D. 四种金属的活泼性顺序是D>A>B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为铁在一定条件下的转化关系图。

请回答:
(1)“曾青得铁则化为铜”的反应有:Fe + CuSO4 = FeSO4 + Cu,该反应的还原剂是_____________(填化学式);
(2)工业上,向500-600℃的铁屑中通入Cl2生产FeCl3,向FeCl3溶液中滴加KSCN溶液,观察到的现象是溶液变成____________色;
(3)图2为原电池装置示意图,此装置可以把化学能转化为_________能,其中铁作_____极;

(4)Fe3O4中Fe既有+2价又有+3价,则+2价和+3价Fe的个数比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的操作方法中不正确的是
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:直接加热
C.N2 中有少量的O2:通过灼热的铜网
D.Na2CO3中混有NH4HCO3:加过量的NaOH溶液加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将9.0 g A完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g。A能与NaHCO3溶液发生反应,且2分子A之间脱水可生成六元环化合物。有关A的说法正确的是 ( )
A. 分子式是C3H8O3 B. A催化氧化的产物能发生银镜反应
C. 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) D. A在一定条件下发生缩聚反应的产物是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硅是制造光导纤维的材料 B. 二氧化硅是制造光电池常用材料
C. 陶瓷含有的主要成分是硅酸盐 D. 水泥、沙子、水玻璃的成分是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子构成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”微粒的说法不正确的是
A.该微粒不显电性 B.该微粒质量数为4
C.与氢元素的质子数相同 D.该微粒质量比氢原子大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备Cu2(OH)2CO3,其工艺流程如下:
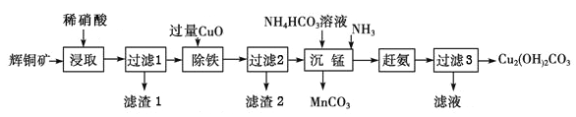
(1)“酸浸”过程中,将矿石粉碎,其目的是__________;加热能加快矿石粉“酸浸”速率,但温度不宜过高,其原因是__________。
(2)Cu2S和硝酸反应,其还原产物为NO。已知1 mol Cu2S完全反应时转移10 mol电子。写出该反应的离子方程式:_____________________。
(3)“除铁”中加入过量氧化铜发生反应的离子方程式为___________________。
(4)从过滤3得到的滤液中可提取一种肥料,它的化学式为__________;滤渣1的主要成分是__________(填化学式)。
(5)设计实验确认过滤2得到的滤液中是否有Fe3+:___________________________。
(6)取wg辉铜矿经上述流程转化,加入agCuO,滤渣2含bgCuO,最终得cmolCu2(OH)2CO3不考虑铜元素损失)。原辉铜矿含Cu2S的质量分数为____________。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种新型、高效的水处理剂,与水反应的化学方程式为:4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH。电解制备 Na2FeO4 装置示意图如下。

(1)a是电源的______________极(填“正”或“负”)。电解时,石墨电极附近溶液的碱性____________(填“增强”、“减弱”或“不变”)。
(2)铁电极的反应式为__________________________。
(3)维持一定的电流强度和电解温度,NaOH起始浓度对Na2FeO4浓度影响如下图(电解液体积相同情况下进行实验)。

①电解3.0h内,随NaOH起始浓度增大,Na2FeO4浓度变化趋势是______________(填“增大”、“不变”或“减小”)。
②当NaOH起始浓度为16mol·L-1,1.0~2.0h内生成Na2FeO4的速率是_____________mol·L-1·h-1。
③A 点与B 点相比,n[Fe(OH)3]: A_____________B (填“>”、 “=”或“<” )
(4)提纯电解所得Na2FeO4,采用重结晶、过滤、洗涤、低温烘干的方法,则洗涤剂最好选用______________溶液(填标号)和异丙醇。
A.Fe(NO3)3 B.NH4Cl C.CH3COONa
(5)次氯酸钠氧化法也可以制得Na2FeO4。
己知 2H2(g)+O2(g)=2H2O (1) △H=akJ·mol-1
NaCl(aq)+ H2O(1)=NaClO(aq)+H2(g) △H=bkJ·mol-1
4Na2FeO4(aq)+10H2O(1)=4Fe(OH)3(s)+3O2(g)+8NaOH(aq) △H=c kJ·mol-1
反应 2Fe(OH)3(s)+3NaClO(aq)+4NaOH(aq)=2Na2FeO4(aq)+3NaCl(aq)+5H2O(1)的△H=______________ kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com