
【题目】t℃时,将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,所得混合溶液中部分离子浓度如下表。
微粒 | H+ | Na+ | A- |
浓度(mol/L) | 2.50×10-10 | 0.100 | 9.92×10-2 |
下列说法中正确的是
A. 所得溶液中: c(Na+) >c(A-) >c(HA) >c(OH-)
B. t℃时,水的离子积Kw < 1.0×10-14
C. t℃时,一元酸HA的电离常数K=3.10×10-8
D. t℃时,0.100mol/LNaA溶液中A-的水解率为0.400%
【答案】C
【解析】根据电荷守恒,c(Na+)+c(H+)=c(A-)+c(OH-),c(OH-)=8×10-4;将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,恰好反应,溶质是0.100mol/L的某一元酸NaA,所得溶液中: c(Na+) >c(A-)>c(OH-)>c(HA),故A错误;t℃时,水的离子积Kw =8×10-4×2.50×10-10=2×10-14> 1.0×10-14,故B错误;根据物料守恒c(A-)+c(HA)=0.1,c(HA)= 8×10-4,t℃时,一元酸HA的电离常数K=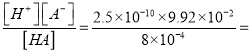 3.10×10-8,故C错误;t℃时,0.100mol/LNaA溶液中A-的水解率为
3.10×10-8,故C错误;t℃时,0.100mol/LNaA溶液中A-的水解率为![]() ,故D错误。
,故D错误。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。
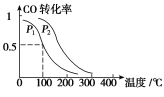
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
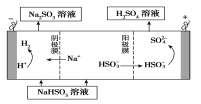
请写出开始时阳极反应的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6﹣己二胺(H2N﹣(CH2)6﹣NH2)毒性较大,可引起神经系统、血管张力和造血功能的改变.下列化合物中能与它发生化学反应的是( )
A. NaOHB. Na2CO3C. NaClD. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T-细胞淋巴瘤,其合成路饯如下图所示:
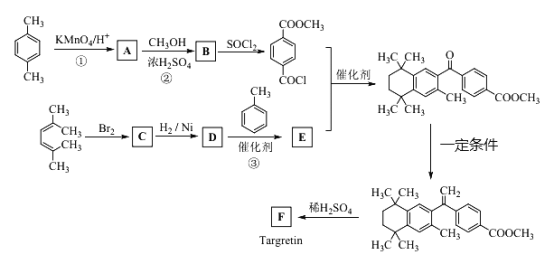
已知:①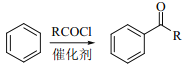
②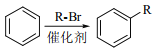
③![]() (R表示烃基或芳基)
(R表示烃基或芳基)
(1)反应①的反应类型是______________________
(2)反应②的化学方程式_________________________________________。
(3)C的结构简式是_____________________________________________。
(4)反应③的化学方程式____________________________________________。
(5)F的分子式C24H28O2,F中含有的官能团____________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构)________________________________。
结构)________________________________。
a.苯环上的一氯代物有两种 b.既发生银镜反应又能发生水解反应
(7)已知: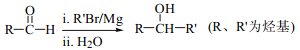 ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的说法中不正确的是:
A. Fe(OH)3胶体与食盐溶液混合将产生聚沉现象
B. Fe(OH)3胶体粒子在电场影响下将向阳极移动
C. 胶体中Fe(OH)3胶体粒子不停地作布朗运动
D. 光线通过Fe(OH)3胶体时会发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期且相邻的元素,B基态原子2p轨道中有三个自旋方向完全相同的电子;C基态原子核外电子占有9个轨道,且只有1个未成对电子;D、E、F是位于同一周期的金属元素, D、E基态原子的价电子层中未成对电子数分别为4、2,且原子序数相差2;F是ds区元素,F基态原子的价电子层中只有1个未成对电子。
回答下列问题:
(1)E元素在周期表中的位置是____________,E的价层电子排布图为________________。E单质能导电的原因是_______________。
(2)A、B、D三种元素形成配合物D3[D(AB)6]2,该配合物的中心离子是___,1 个AB-离子中含有_____个 π键。
(3)A元素最高价氧化物分子中A原子的杂化轨道类型是______,BC3分子的立体构型是_____________。
(4)新制的F(OH)2能够溶解于浓NaOH溶液中形成一种配离子,反应的离子方程式是__。
(5)E、F元素的第二电离能分别是:IE=1753kJ/mol、IF=1958kJ/mol, IF>IE的原因是___。
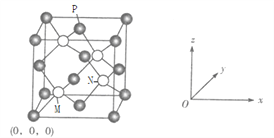
(6)C、F元素形成的一种化合物晶胞如下图,F位于面心和顶点,其晶胞参数为a pm。
①已知M点的坐标为![]() ,则N点的坐标为______,P点的坐标为_______。
,则N点的坐标为______,P点的坐标为_______。
若阿伏加德罗常数用NA表示,则该晶体的密度是_____________g/cm3(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol 配合物与足量AgNO3溶液作用生成1 mol AgCl沉淀,则m、n的值是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=3,n=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. Fe(SCN)3溶液中存在Fe3++3SCN-![]() Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
B. 用通过盛饱和食盐水的洗气瓶来除去氯气中的少量HCl气体杂质
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
D. 合成氨:N2(g)+3H2(g)![]() 2NH3(g) △H<0在高温、高压和催化剂条件下进行
2NH3(g) △H<0在高温、高压和催化剂条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+ ![]() O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1
C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com