
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。
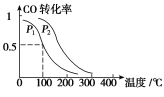
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
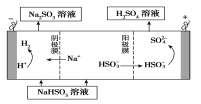
请写出开始时阳极反应的电极反应式________________。
【答案】(1)-90.1(2分)(2)ac(2分)
(3)①小于(1分) ②(V/a)2 (2分) ③增大(1分)
(4)①SO2+2H2O-2e-===4H++![]() (2分)
(2分)
②![]() +H2O-2e-===
+H2O-2e-===![]() +3H+(2分)
+3H+(2分)
【解析】
试题分析:(1)根据已知的热化学方程式和盖斯定律可知,②+③×2-①即得到CO(g)+2H2(g)=CH3OH(g),所以该反应的反应热△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol.
(2)a.使用高效催化剂可以加快反应速率,a正确;b.降低反应温度,反应速率降低,b不正确;c.增大体系压强,反应物的浓度增大,反应速率加快,c正确;d.不断将CH3OH从反应混合物中分离出来,降低生成物浓度,反应速率降低,d不正确,答案选ac。
(3)①根据图像可知,在温度相同时,P2曲线所在的CO转化率大于P1曲线所在的CO转化率。由于正方应是体积减小的可逆反应,增大越强平衡向正反应方向移动,CO的转化率增大,所以P1小于P2。
②由于平衡常数与压强没有关系,所以根据图像可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L) ![]()
![]() 0
0
转化浓度(mol/L) ![]()
![]()
![]()
平衡浓度(mol/L) ![]()
![]()
![]()
所以平衡常数K= -=(
-=(![]() )2
)2
③在其它条件不变的情况下,再增加a mol CO和2a mol H2,相当于是增大体系的压强,平衡向正反应方向进行,达到新平衡时,CO的转化率增大。
(4)①原电池中负极失去电子,发生氧化反应,所以SO2在负极通入,被氧化生成硫酸,负极电极反应式是SO2+2H2O-2e-=4H++SO42-。
②电解池中阳极与电源的正极相连,失去电子,发生氧化反应。所以阳极是HSO3-失去电子被氧化生成
SO42-,则阳极电极反应式是HSO3-+H2O-e-=SO42-+3H+。


科目:高中化学 来源: 题型:
【题目】下列有关Na2O与Na2O2的叙述正确的是
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O是淡黄色物质,Na2O2是白色物质
④Na2O2可作供氧剂,而Na2O不能做供氧剂
⑤Na2O2和Na2O的焰色反应均为黄色
A. 都正确 B. ②③④⑤ C. ②③⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验处理可行的是( )
①.将![]() 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
②.向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热——检验混合物中是否含有甲醛
③.向丙烯醛(CH2=CH—CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④.实验时手指不小心沾上苯酚,立即用70o以上的热水清洗
⑤.用溴水除去混在苯中的己烯,分液得到纯净的苯
⑥.将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和溴水发生了加成反应
A. 只有① B. 只有①④ C. 只有①③④⑥ D. 都不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将NaCl、砂子(SiO2)、I2三者的固体混合物分开,最好的操作顺序是
A. 溶解 过滤 萃取 B. 加热 溶解 过滤
C. 升华 萃取 蒸发 D. 溶解 分液 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列用氨气氮肥的制备反应中,原子利用率最高的是
A.NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl
B.2NH3+CO2=2H2O+CO(NH2)2
C.8NH3+3Cl2=N2+6NH4Cl
D.NH3+HCl=NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一种试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液 ( )
A. 银氨溶液 B. 浓溴水 C. 新制Cu(OH)2浊液 D. FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用自来水养金鱼,在将水注入鱼缸之前,常需把水在阳光下晒一段时间,主要目的是
A. 增加水中氧气的含量 B. 起杀菌作用
C. 使水中的次氯酸分解 D. 使水的温度升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于微量元素的叙述,错误的是 ( )
A. 微量元素是生物生活所必需的,是含量很少的元素
B. 微量元素是维持正常生命活动不可缺少的元素
C. 细胞中所有微量元素的总和少于3%
D. 细胞中常见的微量元素有约20多种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,所得混合溶液中部分离子浓度如下表。
微粒 | H+ | Na+ | A- |
浓度(mol/L) | 2.50×10-10 | 0.100 | 9.92×10-2 |
下列说法中正确的是
A. 所得溶液中: c(Na+) >c(A-) >c(HA) >c(OH-)
B. t℃时,水的离子积Kw < 1.0×10-14
C. t℃时,一元酸HA的电离常数K=3.10×10-8
D. t℃时,0.100mol/LNaA溶液中A-的水解率为0.400%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com