
| ||
| ||
| 6.4g×22.4L |
| 64g |
| 2mol×2.24L |
| 4mol×22.4L |


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、22.4L氨气中含氢原子数目为3NA |
| B、5.6g铁与足量稀硫酸反应转移的电子数为0.3NA |
| C、标准状况下,4.48L的氧气和氨气的混合物含有的分子数目为0.2NA |
| D、80g苛性钠溶于1L水中,所得溶液的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某种核素的相对原子质量 |
| B、某种核素的近似相对原子质量 |
| C、某种元素的平均相对原子质量 |
| D、某种元素的平均相对原子质量的近似值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜、铁、钒都是日常生活中常见的金属,具有广泛用途.
铜、铁、钒都是日常生活中常见的金属,具有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体;C呈黄绿色;F是淡黄色的化合物;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;J能使湿润的红色石蕊试纸变蓝.查看答案和解析>>
科目:高中化学 来源: 题型:

| 试 剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验Ⅰ:产生红褐色沉淀 |
B、 实验Ⅱ:试管中溶液变红色 |
C、 实验Ⅲ:试管中溶液变红色 实验Ⅲ:试管中溶液变红色 |
D、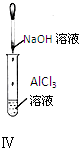 实验Ⅳ:试管中先出现白色沉淀,后溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com