
 Si (s)+ 4HCl(g) ��236kJ
Si (s)+ 4HCl(g) ��236kJ


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g������H��0������
2C��g������H��0������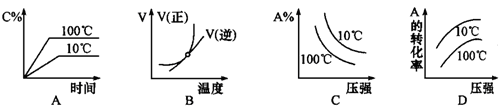
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��
CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��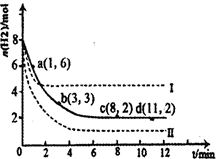
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
 HCOOH + CH3OH �C Q��Q>0��
HCOOH + CH3OH �C Q��Q>0��| ��� | ���ʵ���/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g)+92.4 kJ/mol673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��
2NH3(g)+92.4 kJ/mol673K��30MPa�£������ϳɰ���Ӧ��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ����ͼ��ʾ��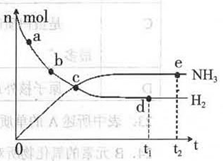
 2NH3(g)��ƽ�ⳣ��ֵΪ��___��
2NH3(g)��ƽ�ⳣ��ֵΪ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
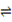 CH3OH(g)+H2O(g) ��H <0 ��500 ��ʱ�������Ϊ1 L�Ĺ̶��ݻ����ܱ������г���1mol CO2��3mol H2�����CO2Ũ����CH3OH Ũ����ʱ��ı仯��ͼ��ʾ�����еó��Ľ��۴������
CH3OH(g)+H2O(g) ��H <0 ��500 ��ʱ�������Ϊ1 L�Ĺ̶��ݻ����ܱ������г���1mol CO2��3mol H2�����CO2Ũ����CH3OH Ũ����ʱ��ı仯��ͼ��ʾ�����еó��Ľ��۴������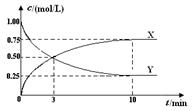
| A������X���Ա�ʾCH3OH(g) ��H2O(g) ��Ũ�ȱ仯 |
| B���ӷ�Ӧ��ʼ��10minʱ��H2�ķ�Ӧ����v(H2)=0.225mol/(L�qmin) |
| C��ƽ��ʱH2��ת����Ϊ75% |
| D��500 ��ʱ�÷�Ӧ��ƽ�ⳣ��K=3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Pb(s) + CO2(g) ��H���÷�Ӧ��ƽ�ⳣ���Ķ���ֵ���¶ȵĹ�ϵ���±�
Pb(s) + CO2(g) ��H���÷�Ӧ��ƽ�ⳣ���Ķ���ֵ���¶ȵĹ�ϵ���±�| �¶� | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |
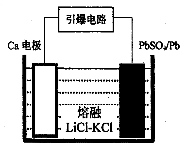
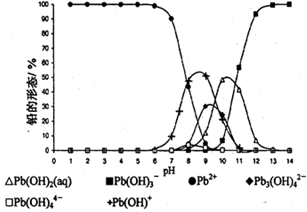
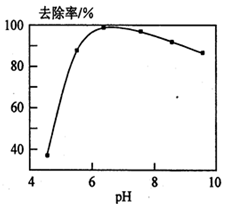
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʱ�䣨s�� C��mol/L�� | �� 0 | �� 20 | �� 40 | �� 60 | �� 80 | �� 100 |
| C��N2O4�� | 0��20 | a | 0��10 | c | d | e |
| C��NO2�� | 0��00 | 0��12 | b | 0��22 | 0��22 | 0��22 |
�鿴�𰸺ͽ���>>
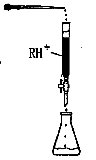
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
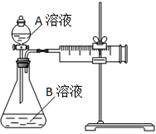
| ʵ����� | A��Һ | B��Һ |
| �� | 20 mL 0.1 mol��L��1H2C2O4��Һ | 30 mL 0.01 mol��L��1KMnO4��Һ |
| �� | 20 mL 0.2 mol��L��1H2C2O4��Һ | 30 mL 0.01 mol��L��1KMnO4��Һ |
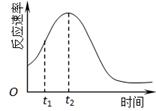
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com