
 CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��
CH3OH(g)��H2O(g)��H����49��0kJ��mol��1��ij��ѧʵ�齫6molCO2��8molH2����2L�ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���ͼ������a��1��6����������˼�ǣ���l minʱH2�����ʵ�����6mol��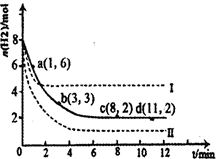
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |

 CH3OH��g��+H2O��g����H=-49.0kJ��mol��1������Ӧ�������С�ķ��ȷ�Ӧ��
CH3OH��g��+H2O��g����H=-49.0kJ��mol��1������Ӧ�������С�ķ��ȷ�Ӧ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g) ��H=һ92. 4 KJ��mol-1
2NH3(g) ��H=һ92. 4 KJ��mol-1 N2(g) +3H2(g)�ں����ܱ������дﵽƽ��ı�־��
N2(g) +3H2(g)�ں����ܱ������дﵽƽ��ı�־��| A���٢ۢ� | B���٢ڢܢ� | C���٢ܢ� | D���ڢۢ� |
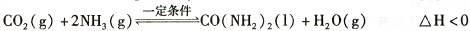
| ʱ�䣯min | ��0 | 30 | 70 | 80 | 100 |
| n(CO2) ��mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
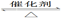 2SO3(g)����H��0��ij�¶��£���2 mol SO2��1 mol O2����10 L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
2SO3(g)����H��0��ij�¶��£���2 mol SO2��1 mol O2����10 L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
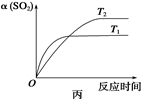
| A����ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol/L |
| B����ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2 |
| C����ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ |
| D��ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OCH3(g)+H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£�������㶨���ܱ������м���һ������CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g)+H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£�������㶨���ܱ������м���һ������CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/mol��L-1 | 0.44 | 0.6 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3F+2G���ô�������ø÷�Ӧ�ڲ�ͬpH�����£�����D��Ũ�ȣ���ÿ����Һ�������ʵ�������ʾ����λΪmg/L���仯��ͼ��ʾ�������й�˵����ȷ����
3F+2G���ô�������ø÷�Ӧ�ڲ�ͬpH�����£�����D��Ũ�ȣ���ÿ����Һ�������ʵ�������ʾ����λΪmg/L���仯��ͼ��ʾ�������й�˵����ȷ����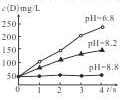
| A��pH=6.8ʱ��D��Ũ�ȣ�mg/L��һ����� |
| B����pH��ͬ�������£�����ѹǿ��D��Ũ�ȣ�mg/L������ |
| C������pH��8.8����ʹ�÷�Ӧ�����淴Ӧ���ʶ�Ϊ0 |
| D���¶���ͬʱ����ͬpH�����£��÷�Ӧ��ƽ�ⳣ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g) ��H<0�������й�������ȷ����
2SO3(g) ��H<0�������й�������ȷ����| A�����{�¶ȣ�v�����v����С |
| B�����º���,����O2��O2��ת�������� |
| C�����º�ѹ������N2��ƽ�ⲻ�ƶ� |
| D�����º��ݣ�ƽ��ǰ����������ܶȱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g) ��H=��92kJ/mol����ֻ�ı�����һ��������һ������������Ӧ������ʹƽ��������Ӧ�����ƶ����ǣ� ��
2NH3(g) ��H=��92kJ/mol����ֻ�ı�����һ��������һ������������Ӧ������ʹƽ��������Ӧ�����ƶ����ǣ� ��| A�������¶� | B������������� |
| C������c(NH3) | D������������Ũ�Ⱦ�����ԭ����2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Si (s)+ 4HCl(g) ��236kJ
Si (s)+ 4HCl(g) ��236kJ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
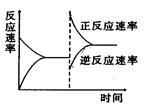
| A�������¶ȣ�ͬʱ��ѹ |
| B�������¶ȣ�ͬʱ��ѹ |
| C������Ӧ��Ũ�ȣ�ͬʱʹ�ô����� |
| D������Ӧ��Ũ�ȣ�ͬʱ��С������Ũ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com