
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是

A. 2F2+2H2O═4HF+O2
B. AgNO3+NaCl═AgCl↓+NaNO3
C. 3CO+Fe2O3  2Fe+3CO2
2Fe+3CO2
D. MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列关于摩尔的说法中,正确的是
A.摩尔是表示物质质量的单位
B.摩尔是国际七个基本物理量之一
C.摩尔既是物质的量的单位,又是粒子的数量单位
D.用物质的量时,要指明粒子种类
查看答案和解析>>
科目:高中化学 来源:2016届宁夏长庆高级中学高三上学期第三次月考理综化学试卷(解析版) 题型:实验题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高二上学期期中测试化学试卷(解析版) 题型:选择题
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
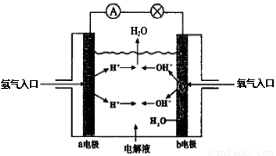
A.a电极是负极
B.b电极的电极反应为:4OH?-4e? =2H2O+O2?
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省宁德市高一上学期期中测试化学试卷(解析版) 题型:选择题
物质的量相同的下列物质中,含原子数最多的是
A.O2 B.CH4 C.CO D.NH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列对于某些离子的检验及结论正确的是
A、某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32一
B、某溶液加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有NH4+
C、某溶液滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一
D、某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
浅绿色的Fe(NO3)2溶液中存在如下平衡:Fe2++2H2O  Fe(OH)2+2H+,若向该溶液中滴加足量盐酸,则溶液的颜色
Fe(OH)2+2H+,若向该溶液中滴加足量盐酸,则溶液的颜色
A. 变黄 B. 绿色更深 C. 绿色更浅 D. 无变化
查看答案和解析>>
科目:高中化学 来源:2016届宁夏育才中学高三上学期第四次月考化学试卷(解析版) 题型:填空题
某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处) KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作为:
A.将碘的四氯化碳溶液置于分液漏斗中;
B.加入适量Na2SO3稀溶液;
C.分离出下层液体;
D.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 ,上述操作正确的顺序是: (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
A.准确称取wg食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南衡阳第八中学高一上六科联赛化学卷(解析版) 题型:填空题
已知稀硝酸与足量的铁发生如下反应:Fe +HNO3 —— Fe(NO3)2+NO↑+H2O (未配平)
(1)该反应的氧化剂是_________,氧化产物是_________。
(2)请将方程式配平并用双线桥法表示出电子转移的方向和数目:
□Fe +□HNO3 ==□Fe(NO3)2+□NO↑+□H2O
(3)当反应中转移 1.5mol 电子,计算被还原的HNO3的物质的量以及生成标准状况下NO气体的体积。(要求写出解答过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com