
| A. | 盐酸与氢氧化钠的反应可自发进行,因此可用作原电池反应原理 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 铝表面可生成一层致密的氧化物薄膜,因此可用铝容器盛装稀硫酸 |
科目:高中化学 来源: 题型:选择题
| A. | 凡金属元素与非金属元素之间都形成离子键 | |
| B. | 形成离子键的微粒必须是金属阳离子与阴离子 | |
| C. | 含有离子键的化合物中,也可能还含有共价键 | |
| D. | 非金属元素形成的化合物一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

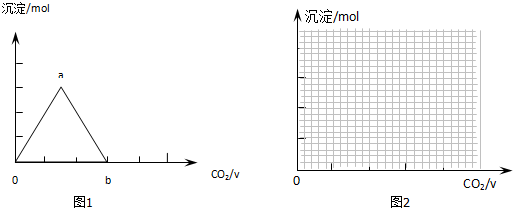
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前工业上常用电解熔融氯化钠法制钠,电解时可用铁作阳极 | |
| B. | 电解熔融CaCl2时,金属钙在阳极生成 | |
| C. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| D. | 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2C1O+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 NH3•H2O+SO2=NH4++HSO3- | |
| D. | 硝酸铁溶液中加入过量氨水 Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 | |
| B. | 炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
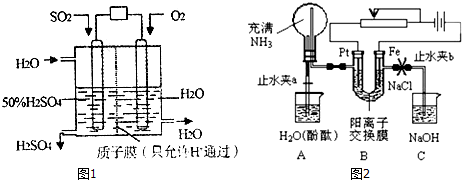
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com