
| A. | 目前工业上常用电解熔融氯化钠法制钠,电解时可用铁作阳极 | |
| B. | 电解熔融CaCl2时,金属钙在阳极生成 | |
| C. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| D. | 电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解 |
分析 A.活性电极作阳极时电极失电子;
B.电解中阳极发生氧化反应,氯离子在阳极放电生成氯气;
C.根据离子放电顺序可知,电解饱和MgCl2溶液生成氢氧化镁、氢气与氯气;
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,降低氧化铝的熔点,使Al2O3在较低温度下熔解.
解答 解:A.活性电极作阳极时电极失电子,所以电解熔融氯化钠法制钠,电解时不能用铁作阳极,应该用惰性电极作阳极,故A错误;
B.电解中阳极发生氧化反应,氯离子在阳极放电生成氯气,钙离子在阴极发生还原反应,阴极析出金属钙,故B错误;
C.根据离子放电顺序可知,电解饱和MgCl2溶液生成氢氧化镁、氢气与氯气,应电解熔融的氯化镁制备金属Mg,故C错误;
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,降低氧化铝的熔点,使Al2O3在较低温度下熔解,故D正确,
故选D.
点评 本题以金属冶炼的原理为载体,考查了电解原理的应用,比较基础,掌握离子放电顺序与电极反应是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
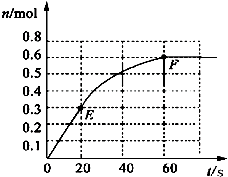 373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠的反应可自发进行,因此可用作原电池反应原理 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 铝表面可生成一层致密的氧化物薄膜,因此可用铝容器盛装稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸馏烧瓶中应加入碎瓷片防止暴沸 | |
| B. | 温度计水银球必须插在液面以下 | |
| C. | 先点燃酒精灯再通入冷却水 | |
| D. | 精制的食盐水蒸馏后可以获得蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量盐酸 | B. | 加入NaOH溶液 | ||
| C. | 置于坩埚中加热 | D. | 配成溶液后通入CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com