
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.【实验目的】制取乙酸乙酯
(1)【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,该反应的化学方程式为 .
(2)【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置: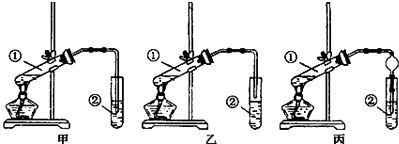
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是(填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是 .
(3)【实验步骤】A按所选择的装置组装仪器,在试管①中先加入3mL95%的乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;
B将试管固定在铁架台上;
C在试管②中加入5mL X试剂;
D用酒精灯对试管①加热
E.当观察到试管②中有明显现象时停止实验.
【问题讨论】
①实验中浓硫酸的作用是 .
②试管2中加入的X试剂为 .
③步骤E试管②中观察到的现象是 .
④常用方法分离获得实验中的乙酸乙酯.
【答案】
(1)CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(2)乙;防止倒吸
(3)催化、吸水;饱和碳酸钠溶液;液体分为两层(有水果味);分液
【解析】解:【实验原理】乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,化学方程式为CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O,所以答案是:CH3COOH+C2H5OH
CH3COOC2H5+H2O,所以答案是:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O; 【装置设计】酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,所以答案是:乙;防止倒吸;
CH3COOC2H5+H2O; 【装置设计】酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,所以答案是:乙;防止倒吸;
【问题讨论】①浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂,所以实验中浓硫酸的作用是:催化、吸水,所以答案是:催化、吸水;②碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,所以试管2中加入的X试剂为:饱和碳酸钠溶液,所以答案是:饱和碳酸钠溶液;③乙酸乙酯难溶于饱和碳酸钠溶液,所以步骤E试管②中观察到的现象是:液体分为两层(有水果味),所以答案是:液体分为两层(有水果味);④因为乙酸乙酯难溶于饱和碳酸钠溶液,分离互不相溶液体的方法是分液,所以常用分液分离获得实验中的乙酸乙酯,所以答案是:分液.


科目:高中化学 来源: 题型:
【题目】氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域.
(1)已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料.其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 899.5 | 1757.1 | 14848.7 | 21006.6 |
B | 738 | 1451 | 7733 | 10540 |
①根据上述数据分析,B在周期表中位于区,其最高价应为;
②若某同学将B原子的基态外围电子排布式写成了ns1np1 , 违反了原理;
③B元素的第一电离能大于Al,原因是;
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.①已知金刚石中的C﹣C的键长为154.45pm,C60中C﹣C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 .
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:

(1)写出三种试剂的化学式:A________,B________,C________。
(2)加过量A的原因是:________________________________________________,
有关反应的化学方程式为:___________________、_____________________。
(3)加过量B的原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体,化学键类型相同,晶体类型也相同的是( )
A.SO2和SiO2
B.NaOH和NaCl
C.NH4Cl 和HCl
D.H2O2和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文物不仅彰显了民族和文化自信,还蕴含许多化学知识。下列说法不正确的是
A.商代“四羊方尊”是青铜制品,青铜属于铜的合金
B.宋代《莲塘乳鸭图》所用宣纸,其主要成分是纤维素
C.清代“瓷母”是指各种釉彩大瓶,主要成分是二氧化硅
D.东晋《洛神赋图》中的颜料铜绿,主要成分属于盐类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,则下列说法正确的是( )
A.1mol苯酚中“C═C”的个数为3 NA
B.常温常压下,22.4L丙烷所含有的共价键数目为10NA
C.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为 ![]() ?NA
?NA
D.2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如右图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2g铜。
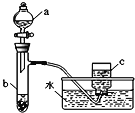
①请写出铜与稀硝酸反应的离子反应方程式_________________________________________。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有__________________________。
③仪器c中收集的气体主要是_______________________。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是______g。
(2)乙组同学对铁与稀硝酸的反应进行探究.他们用amolFe和含有bmolHNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。
①反应结束后的溶液中NO3-的物质的量的取值范围是___________(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+)为3∶1,则b∶a的值为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO![]() →Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
A. Fe3+ B. MnO![]() C. Cl2 D. HNO2
C. Cl2 D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4 . 将反应后的混合气体完全燃烧生成CO2和H2O,所需要氧气的物质的量是( )
A.(3m+n)mol
B.( ![]() m+
m+ ![]() ﹣3p)mol
﹣3p)mol
C.(3m+n+2p)mol
D.( ![]() m+
m+ ![]() )mol
)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com