
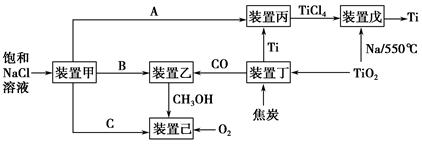
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| | c(CO) | c(H2) | c(CH3OH) |
| 0 min | 0.8 mol·L-1 | 1.6 mol·L-1 | 0 |
| 2 min | 0.6 mol·L-1 | y | 0.2 mol·L-1 |
| 4 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
| 6 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
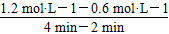 =0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为
=0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为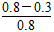 ×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:不详 题型:单选题
| CaAl2Si2O8 | + | Mg2SiO4 | ? | CaMg2Al2Si3O12 | |
| (钙长石) | (镁橄榄石) | (钙镁)石榴子石 | |||
| 摩尔质量(g/mol) | 278 | 140.6 | 413.6 | ||
| 密度(g/cm3) | 2.70 | 3.22 | 3.50 |
| A.钙长石生成 | B.镁橄榄石生成 |
| C.钙长石和镁橄榄石共存 | D.(钙镁)石榴子石生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0ΔS>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )| A.该反应的ΔH>0 |
B.其他条件不变,升高温度反应的平衡常数增大 |
C.300 ℃时,0~t1 min内 CH3OH的平均生成速率为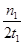 mol·L-1·min-1 mol·L-1·min-1 |
D.A点的反应体系从300 ℃升高到500 ℃,达到平衡时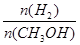 减小 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。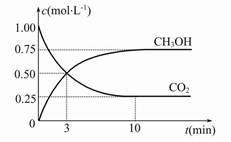
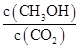 增大的是 (填符号)。
增大的是 (填符号)。| A.升高温度 | B.再充入H2 | C.再充入CO2 | D.将H2O(g)从体系中分离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
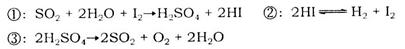
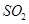 b.
b. c.
c.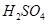 d.HI
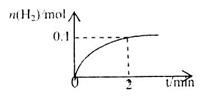
d.HI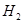 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
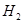 的体积分数
的体积分数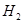 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生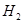 的速率将增大。
的速率将增大。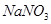 b.
b.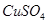 c.
c. d.
d.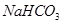
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com