
【题目】HCN是常见的化工原料,其有机衍生物往往以甙的形式广泛存在于植物界中。
(1)HCN中三种元素的电负性从大到小的顺序为___。
(2)室温时HCN的Ka=6.2×10-10,写出HCN的电离方程式:___;向NaCN溶液中通入CO2,发生反应的离子方程式为___(H2CO3的Ka1=4.45×10-7、Ka2=4.7×10-11)。
(3)已知下列热化学反应:
N2(g)+3H2(g)=2NH3(g) ΔH1=-91.8kJ·mol-1
C(s)+2H2(g)=CH4(g) ΔH2=-75.0kJ·mol-1
H2(g)+2C(s)+N2(g)=2HCN(g) ΔH3=+270.0kJ·mol-1
则反应NH3(g)+CH4(g)=HCN(g)+3H2(g)的ΔH=___kJ·mol-1。
(4)测定木薯肉水解产物中HCN含量的步骤如下:称取ag木薯肉进行水解,将产生的HCN蒸出,用V1mLc1mol·L-1Hg(NO3)2溶液吸收HCN,[Hg(NO3)2+2HCN=Hg(CN)2+2HNO3];以NH4Fe(SO4)2·12H2O作指示剂,用c2mol·L-1KSCN标准溶液滴定上述剩余的Hg(NO3)2,[Hg(NO3)2+2KSCN=Hg(SCN)2+2KNO3];滴定至终点时消耗KSCN溶液V2mL。该木薯肉样品中所含HCN的质量分数c(HCN)=___(用c1、c2、V1、V2表示)。
【答案】N>C>H HCN![]() H++CN- CO2+CN-+H2O=HCO
H++CN- CO2+CN-+H2O=HCO![]() +HCN +255.9
+HCN +255.9 ![]() ×100%
×100%
【解析】
(1)同一周期元素,从左到右电负性依次增强,H的电负性小于C,故三种元素的电负性从大到小的顺序为N>C>H;
(2)HCN是弱酸,在水中部分电离,电离方程式为:HCN![]() H++CN-;根据H2CO3的Ka1=4.45×10-7、Ka2=4.7×10-11以及HCN的Ka=6.2×10-10,可以推断出酸性H2CO3> HCN>
H++CN-;根据H2CO3的Ka1=4.45×10-7、Ka2=4.7×10-11以及HCN的Ka=6.2×10-10,可以推断出酸性H2CO3> HCN>![]() ,故向NaCN溶液中通入CO2时生成HCO
,故向NaCN溶液中通入CO2时生成HCO![]() 和HCN,反应的离子方程式为:CO2+CN-+H2O=HCO
和HCN,反应的离子方程式为:CO2+CN-+H2O=HCO![]() +HCN;
+HCN;
(3)设N2(g)+3H2(g)=2NH3(g) ΔH1=-91.8kJ·mol-1为式①,
C(s)+2H2(g)=CH4(g) ΔH2=-75.0kJ·mol-1为式②,
H2(g)+2C(s)+N2(g)=2HCN(g) ΔH3=270.0kJ·mol-1为式③,
反应NH3(g)+CH4(g)=HCN(g)+3H2(g)可表示为![]() ×(③-2×②-①),故ΔH=
×(③-2×②-①),故ΔH=![]() ;
;
(4)Hg(NO3)2的物质的量为c1V1![]() mol,KSCN的物质的量为c2V2
mol,KSCN的物质的量为c2V2![]() mol,由Hg(NO3)2~2KSCN可知,与KSCN反应的Hg(NO3)2的物质的量为
mol,由Hg(NO3)2~2KSCN可知,与KSCN反应的Hg(NO3)2的物质的量为![]() mol,则与HCN反应的Hg(NO3)2的物质的量为(c1V1
mol,则与HCN反应的Hg(NO3)2的物质的量为(c1V1![]() -
-![]() )mol,由Hg(NO3)2~2HCN可得HCN的物质的量为(c1V1
)mol,由Hg(NO3)2~2HCN可得HCN的物质的量为(c1V1![]() -
-![]() )×2=
)×2=![]() ,HCN的质量分数为
,HCN的质量分数为![]() ×100%;
×100%;


科目:高中化学 来源: 题型:
【题目】在一定温度下,容积不变的密闭容器中发生反应:![]() ,下列不能说明该可逆反应已经达到平衡状态的是( )
,下列不能说明该可逆反应已经达到平衡状态的是( )
A. 混合气体压强不再发生变化B. 混合气体质量不再发生变化
C. 反应中CO与![]() 的物质的量之比为1:1D. 生成n mol CO的同时生成n mol
的物质的量之比为1:1D. 生成n mol CO的同时生成n mol ![]() (g)
(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.SO3、![]() 、
、![]() 、
、![]() 的空间构型均为三角锥形
的空间构型均为三角锥形
C.NH3、![]() 、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:

①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料乙醇的生产过程示意图如图所示:
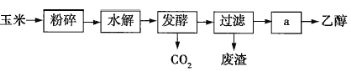
(1)粉碎玉米的目的是__________________________________。
(2)玉米中所含有机物的主要成分是________(填名称)。
(3)步骤a的操作是________(填名称)。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的![]() 的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
(5)用葡萄糖制乙醇的化学方程式可表示为![]() 。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜酸镧是一种反铁磁绝缘体,可由Cu(NO3)2和La(NO3)3为起始原料、水为溶剂、柠檬酸为络合剂,采用溶胶—凝胶法制备。
(1)Cu2+基态核外电子排布式为___。
(2)与NO![]() 互为等电子体的阴离子为___。
互为等电子体的阴离子为___。
(3)柠檬酸(结构简式为 )分子中碳原子的轨道杂化类型为___;1mol柠檬酸分子含σ键数目为___mol。
)分子中碳原子的轨道杂化类型为___;1mol柠檬酸分子含σ键数目为___mol。
(4)铜酸镧的晶胞结构如图所示,写出其化学式:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验I.探究Na2CS3的性质:
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
③ | 向另一份溶液中滴加硫酸酸化的KMnO4溶液,紫色褪去 |
(1)H2CS3是___(填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为___。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点并说明理由:___。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0molL-1的稀H2SO4,关闭活塞。

已知:CS32-+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___。反应开始前需要先通入一段时间N2,其作用为___。
(5)B中发生反应的离子方程式为___。
(6)反应结束后打开活塞K,再缓慢通入一段时间的热N2,其目的是___。
(7)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铝土矿![]() 含
含![]() 、FeO、
、FeO、![]() 、
、![]() 中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量![]() :
:![]() 、
、![]() 、
、![]() 、
、![]()
B.通入过量氨气:![]() 、
、![]() 、
、![]() 、
、![]()
C.加入过量NaOH溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
D.加入过量NaClO溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是多孔石墨电极。某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是( )

A.断开K2,闭合K1一段时间,溶液的pH变大
B.断开K1,闭合K2时,b极上的电极反应为2H++2e-=H2↑
C.断开K2,闭合K1时,a极上的电极反应为4OH--4e-=O2↑+2H2O
D.断开K1,闭合K2时,OH-向b极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com