
| 密度(g/cm3) | 熔点(.C) | 沸点(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
分析 Ⅰ.根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
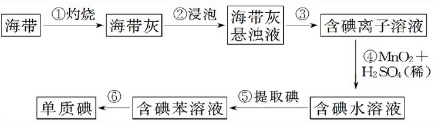
Ⅱ.海带灼烧后得到海带灰浸泡后得到海带灰的浊液,过滤得到含碘离子的溶液加入二氧化锰和稀硫酸氧化碘离子为碘单质,得到含碘水溶液,加入有机溶剂苯,萃取分液得到含碘的苯溶液,通过蒸馏得到碘单质,
(1)灼烧海带时,用酒精进行润湿易于燃烧,灼烧固体分析用到的实验仪器;
(2)分离固体和液体用过滤,分离互溶的两种液体用蒸馏;
(3)萃取剂的选择原理:水溶液中互不相容,要萃取的物质在其中的溶解度大于在水中的溶解度;
Ⅲ.自来水中含有氯离子,氯离子和银离子反应生成不溶于稀硝酸的白色沉淀.
解答 解:Ⅰ.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行;钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤.最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,杂质除干净了就可以蒸发得到精盐.所以正确的顺序为:BCDA或CBDA,故答案为:BCDA或CBDA;
Ⅱ.(1)灼烧海带时,用酒精进行润湿的目的是,促进海带快速燃烧,灼烧固体物质一般使用(瓷)坩埚、玻璃棒、泥三角、酒精灯、坩埚钳等,使用到的硅酸盐质实验仪器选BDF,
故答案为:BDF;
(2)步骤③是分离固体和液体,则实验操作为过滤,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是萃取分液,故答案为:过滤;萃取分液;
(3)萃取剂的选择原理:苯比水轻和水互不相溶,要萃取的物质在其中的溶解度大于在水中的溶解度,可以选择苯,
故答案为:苯密度小于水苯与水互不相溶 碘在苯中的溶解度比在水中大;
Ⅲ.识别用自来水假冒的矿泉水或纯净水的方法是:取少量水样,加入硝酸银溶液,若生成白色沉淀,加稀硝酸沉淀不溶解,则证明Cl2对自来水进行杀菌消毒,
故答案为:取少量水样,加入硝酸银溶液,若生成白色沉淀,加稀硝酸沉淀不溶解,说明含有氯离子,则证明是Cl2对自来水进行杀菌消毒.
点评 本题是一道有关点的检验知识题目,碘单质和遇到淀粉会变蓝色是解题的关键所在,可以根据所学知识进行回答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
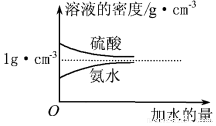
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-) | |
| B. | 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O中含有氢原子数目为2NA | |
| B. | 17 g NH3所含质子数为10NA | |
| C. | 0.1mol Cu(NO3)2中含有的离子数目为0.2NA | |
| D. | 28g N2 体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下用焦炭还原SiO2制取粗硅 | |
| B. | 晶体硅熔点高硬度大,因此可用于制作半导体材料 | |
| C. | 石英只能用于生产光导纤维 | |
| D. | 玻璃容器可长期盛放各种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
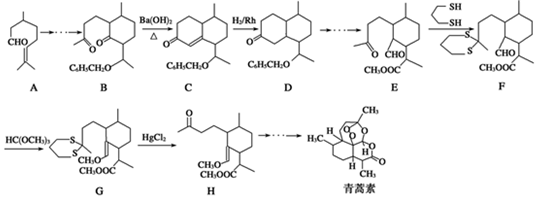
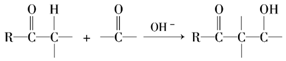 .
.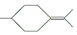 ,则异蒲勒醇的结构简式为
,则异蒲勒醇的结构简式为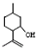 .
.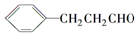 )的合成路线流程图(无机试剂任选).
)的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与稀盐酸反应:H++OH-=H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+=2Na++H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com