
【题目】下列化学式只能表示一直物质的是( )
A.C3H8 B.C4H10 C.C5H12 D.C2H4Cl2
科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3—CH=CH—COOH。现有: ①氯化氢、 ②溴水、 ③纯碱溶液、 ④乙醇、 ⑤酸性高锰酸钾溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是 ( )
A.只有②④⑤ B.只有①③④ C.只有①②③⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究——按如图装置(固定装置已略)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是 ;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 ;
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 ;
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验II:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O。则a∶b= 。
cCu2S+dCuSO4+eH2O。则a∶b= 。
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料。
资料1:
硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
14 | Cu 片表面无明显现象 | |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的如下结论中正确是 。
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度 ≥ 15 mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g) + F(s) ![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
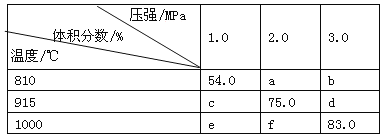
①b<f
②915 ℃、2.0 MPa时E的转化率为60%
③该反应的ΔS>0
④K(1 000 ℃)>K(810 ℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草,从草中获得化合物和元素,那么,牛和草的化学元素的种类以及相同化学元素的含量上分别是( )
A. 种类差异很大,含量上大体相同
B. 种类和含量差异都很大
C. 种类和含量都是大体相同
D. 种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
![]() +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
![]() +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______![]() +______Fe2++______H+ =______Mn2++______Fe3++______H2O
+______Fe2++______H+ =______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO4溶液1000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L (保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,注入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在标准状况下的四种气体①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是 (填序号)。
(2)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积分数为____________。
(3)某物质A加热时按化学方程式2A═2B+C+3D分解,产物均为气体,测得由生成物组成的混合物气体对H2的相对密度为20,则反应物A的摩尔质量为____________。
(4)80 g密度为1 gcm-3的CaCl2溶液里含2 g Ca2+,从中再取出一半的溶液中Cl-的物质的量浓度是 。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放.某含汞酸性废水(主要含Hg2+、H+、Na+、Cl﹣等)的处理工艺流程如图所示.

请回答:
(1)含汞废水未经处理直接排放的危害是(填字母) .
a.造成水体污染 b.引起人体中毒
(2)调节废水pH时加入的溶液A可能是(填字母) .a.盐酸b.NaOH溶液
(3)Na2S与Hg2+发生反应的离子方程式是 .
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl﹣ | SO42﹣ |
浓度(mol/L) | 3.0×10﹣4 | 2.0×10﹣4 | 2.5×10﹣4 |
则c(Fe2+)= mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com