
【题目】下列溶液中有关物质的物质的量浓度的大小关系正确的是
A.常温下,在![]() 的HCOONa溶液中:
的HCOONa溶液中:![]()
B.![]() 溶液中:
溶液中:![]()
C.室温下,由![]() 的
的![]() 溶液与
溶液与![]() 的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:
的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:![]()
D.相同物质的量浓度的下列溶液中,①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() ;
;![]() 由大到小的顺序是:②>①>③>④
由大到小的顺序是:②>①>③>④
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25
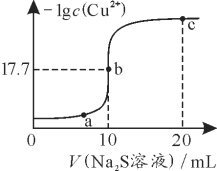
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B. a、b、c三点对应的溶液中,水的电离程度最大的为b点
C. 该温度下,Ksp(CuS)=1×10-35.4
D. 向100 mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是

①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A. ①和② B. ①和③
C. ②和③ D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

(1)据图判断该反应是______(填“吸”或“放”)热反应,当反应达 到平衡后,其他条件不变,升高温度,反应物的转化率____(填“增大”、“减小”或“不变”)
(2)其中B历程表明此反应采用的条件为___(选填下列序号字母),作出正确的判断的理由为________
A、升高温度 B、增大反应物的浓度 C、降低温度 D、使用了催化剂
(3)若△H的数值为200kJ/mol,则x值应为__kJ/mol.此反应在A反应历程中的正反应的活化能为 _____kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
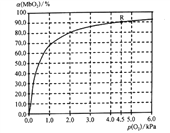
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是石油化工的重要原料,一定条件下可发生下列转化:

已知:![]()
(1)A的结构简式为:____________;
(2) 反应④的类型为:_________________反应;反应⑦进行所需的条件是:_________。
(3)D与足量乙醇反应生成E的化学方程式为:__________________。
(4) 与足量NaOH溶液反应的化学方程式为_________________。
与足量NaOH溶液反应的化学方程式为_________________。
(5)B的同分异构体有多种.写出其中一种既能发生银镜反应,又能发生酯化反应,并且核磁共振氢谱峰值为6:1:1的同分异构体的结构简式:_____________________。
(6)请写出以丙烯为原料制备聚2-羟基丙酸的合成路线,无机试剂任选。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知Ba(AlO2)2能溶于水。如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列叙述正确的是 ( )
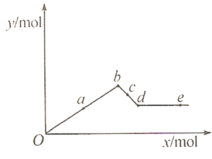
A.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
B.c-d时溶液中离子的物质的量:![]() 比Ba2+少
比Ba2+少
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑧ | ⑩ | |||||
三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
四 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是__(写序号),得电子能力最强的原子是___(用元素符号表示);元素⑦的最高价氧化物对应的水化物是___(写化学式)。
(2)元素④的离子结构示意图为__。③与⑧形成的化合物的电子式:___。
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示)___。
(4)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式:___。
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为___。
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com