
【题目】己知Ba(AlO2)2能溶于水。如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列叙述正确的是 ( )
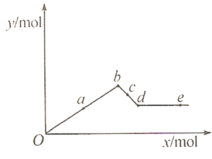
A.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
B.c-d时溶液中离子的物质的量:![]() 比Ba2+少
比Ba2+少
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:
【题目】I.NaHSO3、CuSO4为实验室常用的化学试剂,均易溶于水,且水溶液显酸性。在铁片镀铜实验中,为提高电镀效果,常用CuSO4溶液作为电镀液。装置如图所示,a接电源_____极,阳极的电极反应式为:_____。电镀过程中c(Cu2+)_____(填“基本不变”、“变大”或“变小”)。

II.某实验小组对NaHSO3溶液分别与CuSO4、CuCl2溶液的反应进行探究。
实验 | 装置 | 试剂x | 操作及现象 |
A |
| 1mol·L1CuSO4溶液 | 加入2mLCuSO4溶液,得到绿色溶液,3分钟未见明显变化。 |
B | 1mol·L1CuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(1)推测实验B产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到_____,反应的离子方程式为_____。
(2)对实验B产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与HSO![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是_____;
②实验表明假设b合理,实验B反应的离子方程式有_____、H++HSO![]() =SO2↑+H2O。
=SO2↑+H2O。
(3)对比实验A、B,提出假设:Cl-增强了Cu2+的氧化性。下述实验C证实了假设合理,装置如图(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形管_____________________________________(补全实验操作及现象)。

(4)将实验A的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和SO![]() 。已知:
。已知:
I.![]() ;
;
II.
III.Cu2O是一种红色粉末状固体,几乎不溶于水,但溶于氨水,成稳定的、无色的配合物[Cu(NH3)2]+。
①通过实验D证实红色沉淀中含有Cu+和Cu2+。
实验D:
证实红色沉淀中含有Cu+的实验证据是_____;
②有同学认为实验D不足以证实红色沉淀中含有Cu2+,设计实验D的对比实验E,证实了Cu2+的存在。实验E的方案和现象是_____。(要求:用图示表示,参照实验D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的物质的量浓度的大小关系正确的是
A.常温下,在![]() 的HCOONa溶液中:
的HCOONa溶液中:![]()
B.![]() 溶液中:
溶液中:![]()
C.室温下,由![]() 的
的![]() 溶液与
溶液与![]() 的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:
的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:![]()
D.相同物质的量浓度的下列溶液中,①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() ;
;![]() 由大到小的顺序是:②>①>③>④
由大到小的顺序是:②>①>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
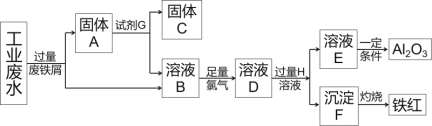
(1)固体A的成分是____(用化学式表示)。
(2)写出B→D的离子方程式____,该反应中氧化剂是____,2 mol Cl2参加反应转移电子数____,溶液D中滴加KSCN溶液的现象是____。
(3)D→E反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=______。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
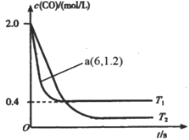
①据此判断该反应的正反应为________(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正- v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(2)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:
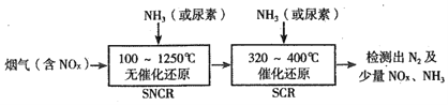
①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为______________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+ O2(g)=2H2O(l) ΔH1=-572 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 242 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶2B.1∶3C.1∶4D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的实验操作,不能实现相应实验目的的是
A.鉴别甲苯与己烷 | B.实验室制备乙酸乙酯 | C.检验电石与饱和食盐水的产物乙炔 | D. 比较乙酸、碳酸与苯酚酸性强弱 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com