
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
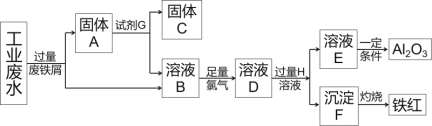
(1)固体A的成分是____(用化学式表示)。
(2)写出B→D的离子方程式____,该反应中氧化剂是____,2 mol Cl2参加反应转移电子数____,溶液D中滴加KSCN溶液的现象是____。
(3)D→E反应的离子方程式是____。
【答案】Fe、Cu 2Fe2+ + Cl2 =2Fe3+ + 2Cl- Cl2 4mol或4×6.02×1023 溶液呈血红色 Al3+ + 4OH- =![]() + 2H2O
+ 2H2O
【解析】
流程工业废水中含Fe3+、Al3+、Cu2+,加过量铁发生2Fe3++Fe═3Fe2+、Fe+Cu2+═Cu+2Fe2+,由于铁过量,过滤分离出固体A为Fe、Cu,溶液B含Al3+、Fe2+,固体A中加试剂为盐酸,过滤分离出固体C为Cu;溶液B中加足量氯气发生2Fe2++Cl2=2Fe3++2Cl-,溶液D中含Al3+、Fe3+,为分离Al3+、Fe3+,H为NaOH(或其它强碱),沉淀F为Fe(OH)3,灼烧F得到铁红;溶液E含NaAlO2,溶液E中通入足量的CO2得到Al(OH)3,过滤后加热Al(OH)3得到Al2O3。
(1)固体A的成分是Fe、Cu,故答案为:Fe、Cu;
(2)B→D的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Cl元素的化合价降低,该反应中氧化剂是Cl2,2mol Cl2参加反应转移电子为2mol×2×(1-0)=4mol,或4×6.02×1023;因为溶液D中含Fe3+,溶液D中滴加KSCN溶液的现象是溶液呈血红色,故答案为:2Fe2++Cl2=2Fe3++2Cl-;Cl2;4mol或4×6.02×1023;溶液呈血红色;
(3)铝盐和过量的强碱反应生成偏铝酸盐和水,D→E反应的离子方程式是Al3+ + 4OH- =![]() + 2H2O,故答案为:Al3+ + 4OH- =
+ 2H2O,故答案为:Al3+ + 4OH- =![]() + 2H2O。
+ 2H2O。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图所示,用石墨电极电解饱和食盐水。下列说法不正确的是( )
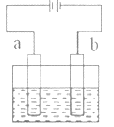
A.通电使NaCl 发生电离
B.电极a 是阳极
C.Na+向 b 极移动
D.a 极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是

①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A. ①和② B. ①和③
C. ②和③ D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
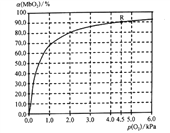
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是石油化工的重要原料,一定条件下可发生下列转化:

已知:![]()
(1)A的结构简式为:____________;
(2) 反应④的类型为:_________________反应;反应⑦进行所需的条件是:_________。
(3)D与足量乙醇反应生成E的化学方程式为:__________________。
(4) 与足量NaOH溶液反应的化学方程式为_________________。
与足量NaOH溶液反应的化学方程式为_________________。
(5)B的同分异构体有多种.写出其中一种既能发生银镜反应,又能发生酯化反应,并且核磁共振氢谱峰值为6:1:1的同分异构体的结构简式:_____________________。
(6)请写出以丙烯为原料制备聚2-羟基丙酸的合成路线,无机试剂任选。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成![]() 和
和![]() ,且二者物质的量相等,则此有机物的组成为
,且二者物质的量相等,则此有机物的组成为![]()
B.—定压强下, ![]() 气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为
气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为![]() ,则生成的水蒸气的体积为
,则生成的水蒸气的体积为![]()
C.相同质量的烃,完全燃烧,消耗![]() 越多,烃中含氢量越高
越多,烃中含氢量越高
D.某气态烃![]() 与足量
与足量![]() 恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则
恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则![]() ;若体积减小,则
;若体积减小,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知Ba(AlO2)2能溶于水。如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列叙述正确的是 ( )
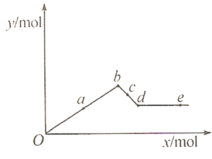
A.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
B.c-d时溶液中离子的物质的量:![]() 比Ba2+少
比Ba2+少
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时有关弱酸的电离平衡常数如下表:
时有关弱酸的电离平衡常数如下表:
弱酸化学式 | HX | HY |
|
电离平衡常数 |
|
|
|
下列推断正确的是![]()
A.HX、HY两种弱酸的酸性:![]()
B.相同条件下溶液的碱性:![]()
C.结合![]() 的能力:
的能力:![]()
D.HX与![]() 反应,无气泡产生
反应,无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有核电荷数小于18的元素A,其电离能数据如表所示[I1表示失去第1个电子的电离能,In(n=2,3,4,5,6,7,8,9,10,11)表示失去第n个电子的电离能,单位为eV]。
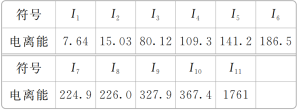
(1)外层电子离核越远,能量越高,电离能越______(填“大”或“小”);阳离子所带电荷数越多,在失去电子时,电离能越________(填“大”或“小”)。
(2)上述11个电子分属________个电子层。
(3)去掉11个电子后,该元素还有________个电子。
(4)该元素的最高价氧化物对应的水化物的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com