
【题目】下列说法正确的是( )
A.某有机物燃烧只生成![]() 和
和![]() ,且二者物质的量相等,则此有机物的组成为
,且二者物质的量相等,则此有机物的组成为![]()
B.—定压强下, ![]() 气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为
气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为![]() ,则生成的水蒸气的体积为
,则生成的水蒸气的体积为![]()
C.相同质量的烃,完全燃烧,消耗![]() 越多,烃中含氢量越高
越多,烃中含氢量越高
D.某气态烃![]() 与足量
与足量![]() 恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则
恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则![]() ;若体积减小,则
;若体积减小,则![]()
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷(P4)和P4O6的分子结构如图所示,
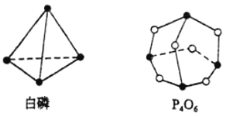
已知:
化学键 | P—P | P—O | O=O |
键能(kJ·mol1) | 198 | 360 | 498 |
则反应P4(g)+3O2(g)= P4O6(g)的△H=_________。
(2)已知①2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则制备水煤气的反应C(s)+H2O(g)=CO(g)+ H2(g)的△H=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,工厂为了防止环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
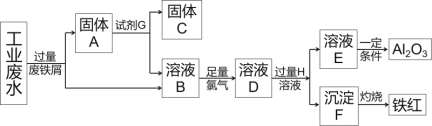
(1)固体A的成分是____(用化学式表示)。
(2)写出B→D的离子方程式____,该反应中氧化剂是____,2 mol Cl2参加反应转移电子数____,溶液D中滴加KSCN溶液的现象是____。
(3)D→E反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有___________、__________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有___________;但溶液的pH不能超过8,其理由是_____________________。
(4)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
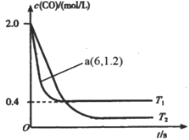
①据此判断该反应的正反应为________(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正- v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(2)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:
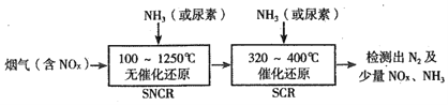
①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为______________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应:H2+Cl2![]() 2HCl,下列说法中正确的是( )
2HCl,下列说法中正确的是( )
A.断开1molH—H键和1molC1—C1键所吸收的总能量大于形成2molH—C1键所放出能量
B.产物所具有的总能量高于反应物所具有的总能量
C.反应物所具有的总能量高于产物所具有的总能量
D.该反应中,化学能只转变为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是( )
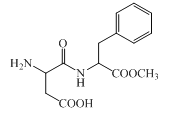
A.分子式为C14H18N2O5
B.不存在顺反异构
C.能发生取代和消去反应
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com