
【题目】(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷(P4)和P4O6的分子结构如图所示,
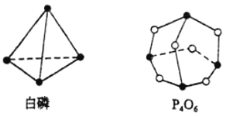
已知:
化学键 | P—P | P—O | O=O |
键能(kJ·mol1) | 198 | 360 | 498 |
则反应P4(g)+3O2(g)= P4O6(g)的△H=_________。
(2)已知①2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
则制备水煤气的反应C(s)+H2O(g)=CO(g)+ H2(g)的△H=_______。
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)O基态原子核外电子排布式为____。H2O VSEPR模型名称为_____,立体构型为___。O3____极性分子(填“是”或“不是”)。
(2)利用热化学法来测定晶格能是由Born与Haber首先提出来的,其实质是利用Hess定律,构成一个热化学循环。
已知:Na(s)+ ![]() Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
Cl2(g)= NaCl(s) ΔH=-410.9 kJ·mol-1
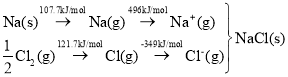
可知,Na原子的第一电离能为_____kJ·mol-1;Cl-Cl键键能为______kJ·mol-1;NaCl晶格能为_____kJ·mol-1。
(3)高压下NaCl 晶体和 Na 或 Cl2 反应,可以形成不同组成、不同结构的晶体,如图是其中一种晶体的晶胞(大球为氯原子, 小球为钠原子),其化学式为________。
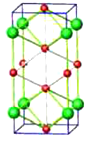
(4)金属Na晶体中的原子堆积方式称为体心立方堆积,晶胞参数为a nm,空间利用率为________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是
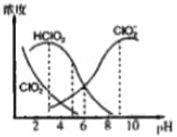
A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
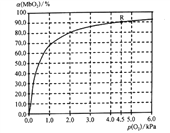
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:
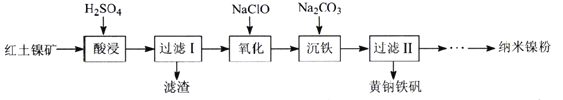
(1)“酸浸”过程,为提高铁和镍元素的浸出率,可采取的措施有___________(写出两种)。
(2)“过滤Ⅰ”滤渣的主要成分是______。
(3)“氧化”过程欲使0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为________ mol。
(4)“沉铁”过程中加入碳酸钠调节浴液的pH至2,生成黃钠铁矾沉淀,写出该反应的化学方程式______。若碳酸钠过多会导致生成的沉淀由黄钠铁矾转变为_____(填化学式)。
(5)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如下图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的物质的量浓度为_____。写出该条件下制备纳米镍粉同时生成N2的离子方程式_____。

(6)高铁酸盐也是一种优良的含铁净水剂,J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为______;Deininger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成![]() 和
和![]() ,且二者物质的量相等,则此有机物的组成为
,且二者物质的量相等,则此有机物的组成为![]()
B.—定压强下, ![]() 气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为
气态烃在足量的氧气中燃烧,将产生的气体通过浓硫酸后气体体积为![]() ,则生成的水蒸气的体积为
,则生成的水蒸气的体积为![]()
C.相同质量的烃,完全燃烧,消耗![]() 越多,烃中含氢量越高
越多,烃中含氢量越高
D.某气态烃![]() 与足量
与足量![]() 恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则
恰好完全反应,如果反应前后气体体积不变(温度大于100℃),则![]() ;若体积减小,则
;若体积减小,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2+N2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
A.υ正(N2)=υ正(H2)B.υ正(N2)=υ逆(NH3)C.3υ正(H2)=2υ逆(NH3)D.3υ正(N2)=υ逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
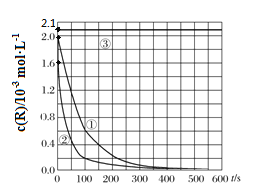
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com