
分析 (1)碘是合成甲状腺激素的主要元素;
(2)含碘最高的食物为海产品,如海带、紫菜、鲜带鱼、蚶干、蛤干、干贝、淡菜、海参、海蜇、龙虾等;
(3)我国为了避免碘元素的摄入不足,常往食盐中加入碘酸钾进行加工成碘盐;根据碘单质遇淀粉试液变蓝色来回答.
解答 解:(1)人体摄入的碘主要是来自海产品和碘盐,碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大和呆小症,
故答案为:B;
(2)含碘最高的食物为海产品,如海带、紫菜、鲜带鱼、蚶干、蛤干、干贝、淡菜、海参、海蜇、龙虾等;
故答案为:海产品;
(3)我国为了避免碘元素的摄入不足,常往食盐中加入碘酸钾进行加工成碘盐;
碘化钾和碘酸钾在酸性条件下能发生氧化还原反应生成碘:5KI+KIO3+6CH3COOH=6CH3COOK+3H2O+3I2,碘遇淀粉试液变蓝色,所以反应现象为:溶液由无色变蓝色,
故答案为:KIO3;溶液由无色变蓝色.
点评 本题结合化学与生活考查了碘及其化合物的性质以及氧化还原反应的概念知识,特别要注意归中反应,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙酸 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙醇和二甲醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯用途之一:可作为植物生长调节剂 | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | 工业上可用乙烯与水在一定条件下进行加成反应制取酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O很稳定,是因为水分子之间存在氢键 | |
| B. | 由于F非金属性最强,HF的氢键键能最大,所以HF的熔、沸点最高 | |
| C. | 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大 | |
| D. | 氨气极易溶于水,与氢键没有关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
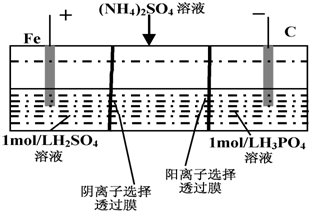
| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的酸性减弱 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定有甲烷 | D. | 一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
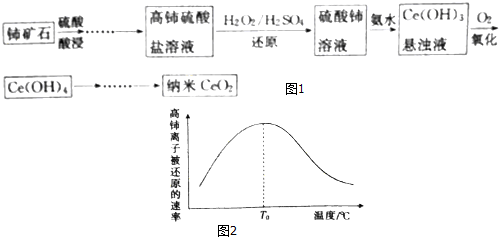
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com