
| A. | Fe(OH)2--红棕色 | B. | BaSO4--灰绿色 | C. | Al(OH)3--白色 | D. | AgCl--蓝色 |
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
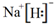 ,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)
,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)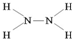 .W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.
.W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
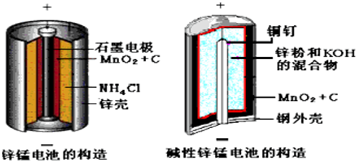
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷与2,2-二甲基丙烷互为同分异构体 | |
| B. | 乙醇和二甲醚互为同分异构体 | |
| C. | 乙醇、乙二醇、丙三醇互为同系物 | |
| D. | 可用溴水来区分乙醇和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H 2O>溴苯>苯 | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O 2量:乙炔>乙烯>乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com