
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

科目:高中化学 来源: 题型:
【题目】向盛有一定量烧碱溶液的烧杯中通入一定量的CO2 气体后,再向所得溶液中逐滴加入盐酸至过量,产生的 CO2 气体与加入 HCl 的物质的量的关系如下图所示(忽略 CO2 的溶解和 HCl的挥发):

请问图中O点对应溶液的溶质为_____(填化学式),其物质的量之比为_____。开始产生 CO2 气体时对应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳捕集封存作为减少温室气体排放的一种手段,受到许多国家的重视,将捕获的二氧化碳转化为可用产品将促进这技术的推广使用。
I.某校科研小组的同学设计用氢氧化钠溶液来“捕捉”二氧化碳,其基本过程如图装置(部分条件及物质末标出)。

(1)在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________,可以循环利用的物质是___________ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3溶液的热化学方程式为____________ 。
(3)下列溶液中,同样能用于“捕捉”二氧化碳的是________(填序号)。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
II.在海洋碳循环中,通过如图所示的途径固碳。

(1)写出钙化作用的离子方程式:______________。
(2)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理:________________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法正确的是( )
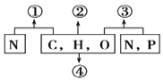
A. 若①为某种大分子的组成单位,则①可能是肽链
B. 若④是主要在动物肝脏和肌肉中合成的储能物质,则④一定是糖原
C. 若③为能储存遗传信息的大分子物质,则③一定是DNA
D. 若②是细胞中重要的储能物质,则②一定是脂肪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为不同化学元素组成的化合物的示意图,下列有关叙述中,正确的是
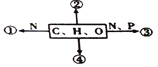
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
C. 若③为生物大分子,则其彻底水解的产物有4种
D. 若②大量积累于皮下和内脏器官周围,则②是磷脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂废渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式可表示为[Fe2(OH)n(SO4)3-0.5n]m,主要工艺流程下:
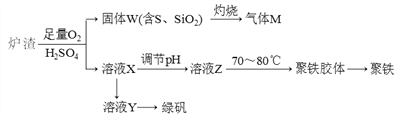
下列说法不正确的是
A. 炉渣中FeS与稀硫酸和氧气反应的离子方程式为:4FeS+3O2+12H+===4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入H2O2溶液得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸干即得绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:

(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是__________________;
(2)以磷化钙为例,写出磷化钙与水反应的化学方程式____________________;检查整套装置气密性良好的方法是_____________________________________。
(3)A中盛装KMnO4溶液的作用是______________________;通入空气的作用是____________。若没有B装置,则实验中测得PH3含量将____________(填“偏低”、“偏高”或“不变”)
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
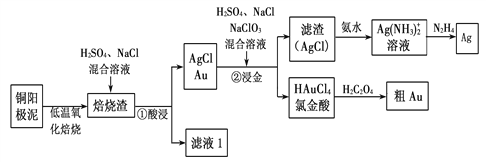
(1)氯金酸(HAuCl4)中的Au的化合价为________。
(2)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________。
(3)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________。
(4)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________。
(6)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合右图分析(其中的纵坐标代表金属阳离子浓度的对数):
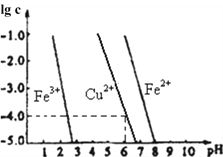
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________________________________,然后加入适量的CuO调节pH=3.7,除去________离子;
②从图中数据计算可得Cu(OH)2的Ksp约为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com