
【题目】下图为不同化学元素组成的化合物的示意图,下列有关叙述中,正确的是
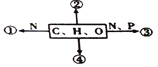
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
C. 若③为生物大分子,则其彻底水解的产物有4种
D. 若②大量积累于皮下和内脏器官周围,则②是磷脂
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
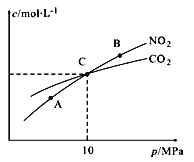
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A. Na2CO3+CaCl2=CaCO3↓+2NaCl
B. Fe+CuSO4=Cu+FeSO4
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析细胞内4种重要有机物的组成及功能,回答下列问题:
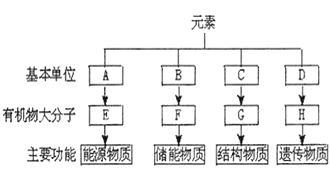
(1)E在动物细胞中是指____,在植物细胞中是指______;组成E的基本单位A是____,可用_____试剂检测。
(2)F是脂肪,可被苏丹Ⅲ染液染成____,脂质还包括____和____等。
(3)C是指______,大约有______种。
(4)生物体内的H主要集中在细胞核内的是______,组成H的基本单位D是_______。
(5)组成E、F、G、H四种有机物共有的元素有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
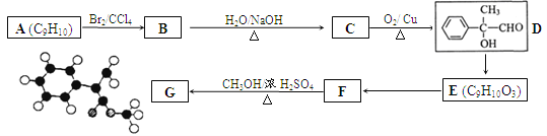
试回答:
(1)G的分子式为 ____________。
(2)A的结构简式为 ___________;D中官能团的名称为 __________。
(3)B→C反应的化学方程式是 ____________________________。
(4)E的同分异构体中可用通式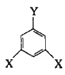 表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________。
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________。(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________。
(4)在本实验的分离过程中,产物应从分液漏斗的____________。(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是____________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。(填正确答案标号)
A.圆底烧瓶 B.温度计 C.吸滤器 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________。(填正确答案标号)
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液、②39%的乙醇溶液、③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com