
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
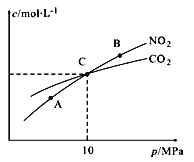
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2 (s) ΔH=-134kJ/mol 2 55 CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O = 2 MPa
H2O(g)+CO(NH2)2 (s) ΔH=-134kJ/mol 2 55 CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O = 2 MPa
【解析】Ⅰ.(1)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJmol-1;②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJmol-1;根据盖斯定律,①+②可得:2NH3(g)+CO2(g)H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol,故答案为:2NH3(g)+CO2(g)H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第2步反应速率慢,所以合成尿素总反应的快慢由第2步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,故答案为:2;55;
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气,电解时,阳极上发生氧化反应得到氧化产物,即为氮气,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
Ⅱ.①A、B两点的温度相同,平衡常数K只与温度有关,故浓度平衡常数关系:Kc(A)=Kc(B);故答案为:=;
②1molNO2和足量C发生该反应,设反应二氧化氮x,列三段式:
2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
n始: 1 0 0
n转: x 0.5x x
n平: 1-x 0.5x x
从图知C点时NO2和CO2的物质的量浓度,则1-x=x,解得x=0.5,则平衡时总的物质的量为1.25mol,C点时该反应的压强平衡常数Kp(C)=  =2MPa;故答案为:2MPa。
=2MPa;故答案为:2MPa。


科目:高中化学 来源: 题型:
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH≠1,0.1mol/L某一元碱BOH溶液里![]() 。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
。将此两种溶液等体积混合后,所得溶液呈的各离子浓度间关系正确的是( )
A.c (A-)>c (B+)>c (H+)>c (OH-)
B.c (B+)=c (A-)>c (H+)=c (OH-)
C.c (OH-)- c (H+)=c(HA)
D.c (B+)+ c (H+)=c (A-)+c (OH-) + c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 由非金属原子形成的化合物一定是共价化合物
B. 离子化合物里可以存在共价键
C. 离子键、共价键、氢键均属于化学键
D. H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(l);△H1=-285.8kJ/mol
N2(g)+2H2(g)=N2H4(l);△H2=+50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_____________。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H>0。
HCN(g)+3H2(g) △H>0。
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%。0~4min內,用H2表示的该反应速率v(H2)=_____。
保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时v正___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
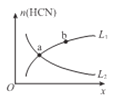
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq )时,其平衡常数的表达式为K稳=_______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3 (aq)![]() Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示发置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
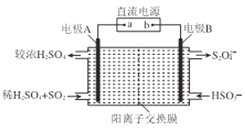
①电极A的电极反应式为______________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体。同时有SO32-生成。该反应离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
A. 0.10 mol/L Ag+ B. 0.20 mol/L Zn2+
C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)己知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),△H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g), △H=-566.0kJ/mol
③H2O(g)=H2O(l), △H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式__________________。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。
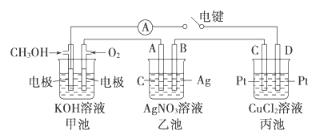
①甲池负极的电极反应为__________________。
②工作一段时间后,测得甲中溶液的pH减小,该电池总反应的离子方程式为______。
③乙池中A(石墨)电极的名称为__________________(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为_________。
④当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为__mL(标准状况),假设乙池、丙池中的溶液均为足量,丙池中____(填“C”或“D”)极析出______g铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子半径依次增大,X、Y同主族,且X、Y原子序数之和是W、Z原子序数之和的2倍。m、n、p、.r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙在常温下均是淡黄色固体。上述物质间的转化关系如图所示(部分生成物已省略)。下列说法正确的是
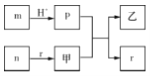
A. 简单离子半径大小:X>Y>Z
B. 热稳定性:r>p
C. 含Y元素的盐溶液可能显酸性、中性,不可能显碱性
D. 二元化合物n 只含离子键,不含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①花生油和水混合液②39%的乙醇溶液③使浑浊的食盐水变澄清,分离上各混合物的正确方法依次是( )
A.分液、过滤、蒸馏
B.过滤、蒸馏、分液
C.分液、蒸馏、过滤
D.蒸馏、过滤、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为不同化学元素组成的化合物的示意图,下列有关叙述中,正确的是
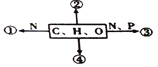
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
C. 若③为生物大分子,则其彻底水解的产物有4种
D. 若②大量积累于皮下和内脏器官周围,则②是磷脂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com