
【题目】①花生油和水混合液②39%的乙醇溶液③使浑浊的食盐水变澄清,分离上各混合物的正确方法依次是( )
A.分液、过滤、蒸馏
B.过滤、蒸馏、分液
C.分液、蒸馏、过滤
D.蒸馏、过滤、分液
科目:高中化学 来源: 题型:
【题目】NaClO2是一种漂白、消毒剂,广泛应用于纸浆、棉纺等物质漂白。一种制备NaClO2粗产品的工艺流程如下图所示:
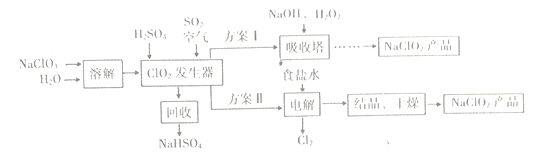
已知:①纯净的ClO2因易分解而发生爆炸。
②NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O晶体;高于38℃时析出
NaClO2晶体;高于60℃时NaClO2分解生成NaClO3和NaCl。
试回答下列问题:
(1)向发生器中鼓入足量空气,其目的是____(选填序号)。
a.将SO2氧化成SO3,以增强酸性
b.稀释CO2气体,以防止发生爆炸
c.将发生器中气体全部吹出,以减少ClO2损失
(2)吸收塔中反应的离子方程式为___
(3)ClO2发生器中反应的化学方程式为___________
(4)从吸收塔中可获得 NaClO2溶液,从NaClO2溶液到NaCO2产品,经过的操作步骤依次为:①______℃下减压蒸发结晶;②________;③洗涤;④低温干燥,得到成品。
(5)“电解”中阳极的电极反应式是_________,阴极反应的主要产物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
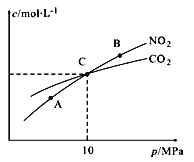
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如右图所示。下列有关说法正确的是

A. 常温下,PbI2的Ksp为2×10-6
B. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL.0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.200 mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解和NH3的挥发)。下列说法不正确的是
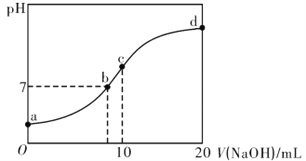
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)><(OH-)
B. 点b所示溶液中:c(NH4+)+c(Na+)=2c(SO42-)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键有如下所示的断裂方式:
 ;
;
 。
。
高分子单体A(C6H10O3)可进行如下反应(反应框图)

已知:
Ⅰ.对框图中某些化合物性质的说明:A在室温下不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na反应放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na反应放出H2。
Ⅱ.两个一OH连在同一个C原子上的结构不稳定。
(1)写出反应①中(1)的反应类型:___________;写出D的键线式:____________________。
(2)写出物质E所含官能团的名称: ____________________。
(3)B在浓H2SO4存在下与甲醇共热反应生成的有机物的系统名称为____________________。
(4)写出F→G的化学反应方程式:____________________________________。
(5)与B互为同分异构体,分子为链状的酯类物质共有______________种(不考虑立体异构)。
(6)请设计合理方案,用物质E制备乙二酸(其他原料自选,用反应流程图表示,并注明必要的反应条件) ______________。例如:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A. Na2CO3+CaCl2=CaCO3↓+2NaCl
B. Fe+CuSO4=Cu+FeSO4
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com