
【题目】常温下,向20.00mL.0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.200 mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解和NH3的挥发)。下列说法不正确的是
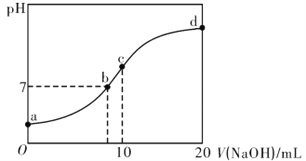
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)><(OH-)
B. 点b所示溶液中:c(NH4+)+c(Na+)=2c(SO42-)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
【答案】D
【解析】A. 点a所示溶液就是0.1000mol·L-1(NH4)2SO4溶液,该溶液因铵根离子水解而显酸性,故c(NH4+)>c(SO42-)>c(H+)><(OH-),A正确;B. 点b所示溶液中,pH=7,即 c(H+)=c(OH-),由电荷守恒可得c(H+)+c(NH4+)+c(Na+)= c(OH-)+2c(SO42-),所以c(NH4+)+c(Na+)=2c(SO42-)>c(H+)=c(OH-),B正确;C. 点c所示溶液中所加氢氧化钠的物质的量恰好为硫酸铵的物质的量相等,溶液中有物质的量相等的3种溶质硫酸铵、硫酸钠和一水合氨,由电荷守恒可得c(Na+)+c(NH4+)+c(H+)=2 c(SO42-) +c(OH-) ,由物料守恒可得,c(Na+)= c(SO42-)、c(SO42-)=c(NH3·H2O)+ c(NH4+),所以,c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-),C正确;D. 点d所示溶液中所加的氢氧化钠恰好与硫酸铵完全反应,得到硫酸钠和氨水的混合液,溶液呈碱性,所以c(NH3·H2O)>c(SO42-)> c(OH-)>c(NH4+),D不正确。本题选D。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
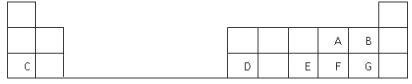
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解100 mL含c(H+)=0.30 mol/L的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
A. 0.10 mol/L Ag+ B. 0.20 mol/L Zn2+
C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子半径依次增大,X、Y同主族,且X、Y原子序数之和是W、Z原子序数之和的2倍。m、n、p、.r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙在常温下均是淡黄色固体。上述物质间的转化关系如图所示(部分生成物已省略)。下列说法正确的是
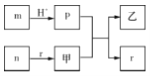
A. 简单离子半径大小:X>Y>Z
B. 热稳定性:r>p
C. 含Y元素的盐溶液可能显酸性、中性,不可能显碱性
D. 二元化合物n 只含离子键,不含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,正确的是
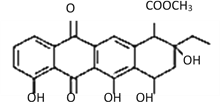
A. 阿克拉酮的分子式为C22H23O8
B. 分子中含有5个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质与 NaOH溶液反应,最多可反应3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①花生油和水混合液②39%的乙醇溶液③使浑浊的食盐水变澄清,分离上各混合物的正确方法依次是( )
A.分液、过滤、蒸馏
B.过滤、蒸馏、分液
C.分液、蒸馏、过滤
D.蒸馏、过滤、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
18-Ⅰ
香茅醛(![]() )可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有_______。
)可作为合成青蒿素的中间体,关于香茅醛的叙述正确的有_______。
A.分子式为C10H18O B.不能发生银镜反应
C.可使酸性KMnO4溶液褪色 D.分子中有7种不同化学环境的氢
18-Ⅱ
当醚键两端的烷基不相同时(R1-O-R2,R1≠R2),通常称其为“混醚”。若用醇脱水的常规方法制备混醚,会生成许多副产物:
R1—OH+ R2—OH ![]() R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
R1—O—R2+ R1—O—R1+ R2—O—R2+H2O
一般用Williamson反应制备混醚:R1—X+ R2—ONa→R1—O—R2+NaX,某课外研究小组拟合成![]() (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:
Ⅰ:![]()
Ⅱ:①![]()
②![]()
③![]()
回答下列问题:
(1)路线Ⅰ的主要副产物有______________、______________。
(2)A的结构简式为______________。
(3)B的制备过程中应注意的安全事项是______________。
(4)由A和B生成乙基苄基醚的反应类型为______________。
(5)比较两条合成路线的优缺点:______________。
(6)苯甲醇的同分异构体中含有苯环的还有________种。
(7)某同学用更为廉价易得的甲苯替代苯甲醇合成乙基苄基醚,请参照路线Ⅱ,写出合成路线______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com