
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.46 g乙醇中含有的化学键数为7NA
B.1 mol氯气和足量NaOH溶液反应转移电子数为2NA
C.1 mol OH-和1 mol —OH(羟基)中含有的质子数均为9NA
D.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO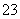 总数为3NA
总数为3NA
科目:高中化学 来源: 题型:
下列对一些事实的理论解释不正确的是
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层电子数有8个而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 同温同压同物质的量的气体体积相等 | 相同条件下气体的分子间平均距离相等 |
| D | 钠投入水中熔成小球 | 该反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式:________________________________。
(2)下列有关海水综合利用的说法正确的是________。
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备镁
D.从海带中提取碘单质的过程不涉及氧化还原反应
(3)液溴呈________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中,将其中的溴离子氧化,反应的离子方程式为________________________,
(4)加碘食盐中的含碘物质是________,碘加热时变成紫色的碘蒸气,这一过程叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氢键下列说法正确的是( )
A.每个水分子内含有两个氢键
B.在水蒸气、水和冰中都含有氢键
C.氢键是化学键
D.氨水中,水分子和氨分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
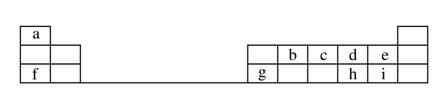
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
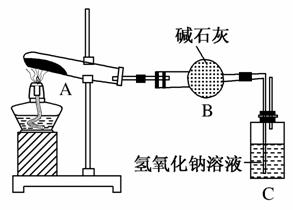
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4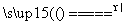 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4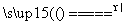 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4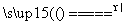 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4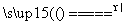 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量 B.1摩尔水蒸气的质量
C.1摩尔水的体积 D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣、CO32﹣等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:下列说法错误的是( )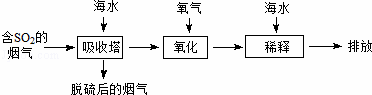
|
| A. | 海水pH约为8的原因主要是天然海水含CO32﹣、HCO3﹣ |
|
| B. | 吸收塔中发生的反应有SO2+H2O⇌H2SO3 |
|
| C. | 氧化主要是氧气将HSO3﹣、SO32﹣、H2SO3氧化为SO42﹣ |
|
| D. | 经稀释“排放”出的废水中,SO42﹣浓度与海水相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B═3C+4D反应中,下面表示的化学反应速率最快的是
A.v(A)=0.5mol/(L•min) B.v(B)=0.05mol/(L•min)
C.v(C)=0.9mol/(L•min) D.v(D)=1.0mol/(L•min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com