
����Ŀ��ij�о���ѧϰС����̽�������Ļ�ѧ���ʣ������ͼ��ʾ��ʵ��װ�á�

��֪����װ�����������ã�ͭ�۷�������������(��ֹӲ�ʲ�����ը��)��
��ش��������⣺
��1��Ϊ��ֹͭ������е�������Ӧ���ڼ���֮ǰӦ�ý��еIJ���Ϊ____��
��2�����۲쵽AgNO3��Һ�г��ְ�ɫ����ʱ����ȼ�ƾ��Ƽ��ȣ�д��AgNO3��Һ�з�����Ӧ�Ļ�ѧ����ʽ��____��
��3��Ӳ�ʲ������еķ�Ӧ����Ϊ____����Ӧ�Ļ�ѧ����ʽΪ____��
��4��װ���п��Թܵ�������____��
��5��ʵ���У��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ____��
��6���ձ�������������Һ��������___��������Ӧ�Ļ�ѧ����ʽΪ_____��
��7��ʢˮ���Թ��У���Һ������ɫΪ___��˵������____(������������������)����ˮ��
���𰸡�ͨ�������ž�װ���еĿ��� Cl2��H2O=HCl��HClO��HCl��AgNO3=AgCl����HNO3 ���ҷ�Ӧ�������ػ�ɫ���� Cu��Cl2![]() CuCl2 ��ֹ�Ҳ��Թ��е�ˮ������Ӳ�ʲ������У�ʹӲ�ʲ�����ը�� �ȱ�����ɫ ����β���е���������ֹ��Ⱦ���� Cl2��2NaOH=NaCl��NaClO��H2O dz����ɫ ��
CuCl2 ��ֹ�Ҳ��Թ��е�ˮ������Ӳ�ʲ������У�ʹӲ�ʲ�����ը�� �ȱ�����ɫ ����β���е���������ֹ��Ⱦ���� Cl2��2NaOH=NaCl��NaClO��H2O dz����ɫ ��
��������
ͨ�������������Ⱥ���ͭ��Ӧ�����Ȼ�ͭ��Ӳ�ʲ������еķ�Ӧ����Ϊ�����ҷ�Ӧ�������ػ�ɫ���̣��Ȼ�ͭ����ˮ����ˮ���գ�ĩ��Ӧ��������ˮ��Ӧ����ˮ������������Ư���ԣ��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ�ȱ�����ɫ����ˮ�к��������ӣ���AgNO3��Һ��Ӧ���ɰ�ɫ�����������ж���β��������������Һ��������ֹ��Ⱦ������
��1��Ϊ��ֹͭ������е�������Ӧ���ڼ���֮ǰӦ�ý��еIJ���Ϊͨ�������ž�װ���еĿ�����
��2��������ˮ��Ӧ��������ʹ����ᣬ���۲쵽AgNO3��Һ�г��ְ�ɫ����ʱ����ȼ�ƾ��Ƽ��ȣ�AgNO3��Һ�з�����Ӧ�Ļ�ѧ����ʽ��Cl2��H2O=HCl��HClO��HCl��AgNO3=AgCl����HNO3 ��
��3��ͭ���������Ⱥ�����Ӧ�����Ȼ�ͭ��Ӳ�ʲ������еķ�Ӧ����Ϊ���ҷ�Ӧ�������ػ�ɫ���̣���Ӧ�Ļ�ѧ����ʽΪCu��Cl2![]() CuCl2 ��
CuCl2 ��
��4��װ���п��Թܵ������Ƿ�ֹ�Ҳ��Թ��е�ˮ������Ӳ�ʲ������У�ʹӲ�ʲ�����ը�ѡ�
��5����ˮ������������Ư���ԣ�ʵ���У��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ�ȱ�����ɫ��
��6�������ж����ձ�������������Һ������������β���е���������ֹ��Ⱦ������������Ӧ�Ļ�ѧ����ʽΪCl2��2NaOH=NaCl��NaClO��H2O��
��7��ʢˮ���Թ��У���Һ������ɫΪdz����ɫ��˵������������ˮ��


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ�У��������ʵ���Ũ�ȹ�ϵ������ȷ����
A. pH=12��Ba��OH��2��Һ��pH=12��Na2CO3��Һ�У�ˮ�����c��H+�����
B. �����£�pH=4�Ĵ�����pH=10��NaOH��Һ�������Ϻ�pH��7
C. ��0.2 molL��1NaA��Һ��0.1 molL��1������Һ�����������ü�����Һ��c��Na+��+c��H+��=c��A����+c��Cl����
D. 0.1 molL��1 Na2CO3��Һ�У�c��Na+��=c��HCO3����+c��H2CO3��+2c��CO32-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС����̽�������Ļ�ѧ���ʣ������ͼ��ʾ��ʵ��װ�á�

��֪����װ�����������ã�ͭ�۷�������������(��ֹӲ�ʲ�����ը��)��
��ش��������⣺
��1��Ϊ��ֹͭ������е�������Ӧ���ڼ���֮ǰӦ�ý��еIJ���Ϊ____��
��2�����۲쵽AgNO3��Һ�г��ְ�ɫ����ʱ����ȼ�ƾ��Ƽ��ȣ�д��AgNO3��Һ�з�����Ӧ�Ļ�ѧ����ʽ��____��
��3��Ӳ�ʲ������еķ�Ӧ����Ϊ____����Ӧ�Ļ�ѧ����ʽΪ____��
��4��װ���п��Թܵ�������____��
��5��ʵ���У��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ____��
��6���ձ�������������Һ��������___��������Ӧ�Ļ�ѧ����ʽΪ_____��
��7��ʢˮ���Թ��У���Һ������ɫΪ___��˵������____(������������������)����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���ʵ������ķ�Ӧ����ʽ��ȷ���ǣ� ��
A.�п��Ľ���Na��¶�ڿ����У����������䰵��2Na��O2=Na2O2
B.��Na�����ˮ�У��������壺2Na��2H2O=2NaOH��H2��
C.Na2O2�ڳ�ʪ�Ŀ����з���һ��ʱ�䣬��ɰ�ɫճ���2Na2O2��2CO2=2Na2CO3��O2
D.����������ȼ�ղ����غ�ɫ���̣�Fe��Cl2=FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪MgCl2+6NH3![]() MgCl2��6NH3�÷�Ӧ���м��õĿ��������Ű����ԡ�ij��������ʵ����̽�������ԣ����а���(����)����װ����ͼ���Ű�����ʵ��װ����ͼ��
MgCl2��6NH3�÷�Ӧ���м��õĿ��������Ű����ԡ�ij��������ʵ����̽�������ԣ����а���(����)����װ����ͼ���Ű�����ʵ��װ����ͼ��

��֪��������ʵ����ʼ��±�

��ش�
(1)ʵ���Ҳ��ù̹̼��ȵķ�ʽ�Ʊ�NH3���Ʊ���Ӧ�ķ���ʽΪ___________�������װ�õ�������___________���������̲��ñ�ˮԡ��ԭ�������___________(��ѡ�������ĸ)��
A ��������Ϊ���ȷ�Ӧ���ٽ���Ӧ�������
B �ӿ췴Ӧ����
C ��ֹ��������Һ�лӷ�����߰���������
D ���������Ȼ�þ���ܽ��
(2)����MgCl2��Һ�Ʊ���ˮMgCl2����������Ϊ______________________��
(3)�ᴿMgCl2��6NH3�����У�����ϴ�Ӽ�����ʵ���___________(��ѡ�������ĸ)��
A ��Ũ��ˮ B �Ҷ�����ˮ�Ļ��Һ
C �������͵ļ״���Һ D �������͵��Ҷ�����Һ
(4)���зŰ�ʵ��ʱ��������ƿ����1.97 g MgCl2��6NH3���ռ��Ũ��Һ�����ȣ�������ͨ��N2��ͨ��N2Ŀ����___________��ͨ���۲��ձ�������ı仯�Ϳ��Լ��MgCl2��6NH3�ķŰ����̣���Ҫ�ж�ת�����Ƿ�ﵽ��90%�����ձ�����Һ������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�صĻ�̬ԭ�ӵĺ��������3������״̬��5�ֿռ�״̬��X�����е�һ��������С��Ԫ�أ�Ԫ��Y��M������˶�״̬��X�ļ۵����˶�״̬��ͬ��Ԫ��Zλ�ڵ������ڣ����̬ԭ�ӵ�2��������M����ȫ���������ӡ�
(1)X��̬ԭ�ӵĵ����Ų�ʽΪ___________��
(2)X���⻯��(H2X)���Ҵ��е��ܽ�ȴ���H2Y����ԭ����___________��
(3)��Y���⻯��(H2Y�����У�Yԭ�ӹ�����ӻ�������___________��
(4)Y��X���γ�YX32����
��YX32�������幹��Ϊ___________(����������)��
��д��һ����YX32����Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___________��
(5)Z���Ȼ����백ˮ��Ӧ���γ������[Z(NH3)4(H2O)2]Cl2������������ʱ������ʧȥ�������е�������___________(д��ѧʽ)��

(6)Y��Z���γɻ����ᄃ��ľ�����ͼ��ʾ���û�����Ļ�ѧʽΪ___________���侧���߳�Ϊ540.0pm���ܶ�Ϊ___________g��cm��3(��ʽ������)��aλ��Y��bλ��Z֮��ľ���Ϊ___________pm(��ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(FeC2O4��nHO)�ܽ����ˮ��0.22g����ˮ��0.026g������ǿ��ԭ�ԣ������������Լ�����Ӱ����ij��ѧС�����ù�ҵ����м�������װ���Ʊ������������塣�ش��������⣺

(1)ʵ��ǰ�轫����м��5%��Na2CO3��Һ�м��Ȳ�������ˮϴ�Ӹɾ�����Na2CO3��Һ��������___________��
(2)��װ��װ�ú�������Ҫ����װ�õ������ԣ��䷽����______________________��ʵ�������װ��c��������______________________��
(3)ʵ����̣�����Ӧװ�������Լ�����Ҫ��aƿ�з�Ӧ�Ƚ���һ��ʱ�����ų����������еIJ����Ǵ�K1��һ����ϡ�������aƿ��ر�K1��ͬʱ��Ҫ���еIJ�����___________��һ��ʱ�����Ҫ��aװ���е�����������Һ����װ��b�У��������___________��
(4)b�����ɵij�������ˡ�ϴ�ӡ����ϴ��ʱ���ѡ�������Լ��е�___________(�����)������ϴ�Ӹɾ��ķ�����___________��
a.���� b����ˮ c��ˮ
(5)ȷ��ȡ9g������������(FeC2O4��nH2O)����ƿ�У�����һ���������ܽⲢ������50�棬Ȼ����1.0mol��L��1��KMnO4����Һ�ζ����ﵽ�ζ��յ�ʱ��ȥ30mL����Һ���ζ���ӦΪ��10(FeC2O4��nH2O)+6KMnO4+24H2SO4=5Fe2(SO4)3+20CO2��+6MnSO4+3K2SO4+(24+10n)H2O��
���жϵζ��յ������Ϊ___________����n=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������(![]() )����Һ���ã�ȡ�ϲ���Һ����ͨ��
)����Һ���ã�ȡ�ϲ���Һ����ͨ��![]() ����Һ�������Ũ��
����Һ�������Ũ��![]() ��
��![]() �Ĺ�ϵ��ͼ��ʾ����֪��
�Ĺ�ϵ��ͼ��ʾ����֪��![]() ��
��![]() ������˵����ȷ����
������˵����ȷ����

A. �ϲ���Һ�У�![]()
B. ��![]() ʱ��
ʱ��![]()
C. ��![]() �ı仯�����У�c(Na+) c(Ur��)��ֵ����С
�ı仯�����У�c(Na+) c(Ur��)��ֵ����С
D. ��![]() ʱ��
ʱ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����������γɵĻ������Ϊ�����������Cu9Al4��Cu5Zn8�ȡ�
(1)ij��������������Է��ԣ�ԭ������ά�ռ�����������������У��ý�������������________(���������������Ǿ�����)��
(2)��̬ͭԭ����________��δ�ɶԵ��ӣ�Cu2���ĵ����Ų�ʽΪ____________________����CuSO4��Һ�м��������ˮ����ַ�Ӧ����������Ҵ�������һ������ɫ���壬�þ���Ļ�ѧʽΪ____________________����������ѧ����____________________���Ҵ�������Cԭ�ӵ��ӻ��������Ϊ________��
(3)ͭ������±��(SCN)2��Ӧ����Cu(SCN)2,1 mol(SCN)2�����к�����������ĿΪ________��(SCN)2��Ӧ������������(H��S��C��N)����������(H��N===C===S)���֡�������ǰ�߷е���ں��ߣ���ԭ����______________________________________________________________________________________��

(4)ZnS�ľ����ṹ��ͼ��ʾ����ZnS�����У�S2������λ��Ϊ_______________��
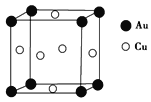
(5)ͭ����γɵĽ���������ľ����ṹ��ͼ��ʾ���侧���߳�Ϊa nm���ý�����������ܶ�Ϊ________ g��cm��3(�ú�a��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com