
【题目】下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
B. 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C. 将0.2 molL﹣1NaA溶液和0.1 molL﹣1盐酸溶液等体积混合所得碱性溶液中c(Na+)+c(H+)=c(A﹣)+c(Cl﹣)
D. 0.1 molL﹣1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
【答案】B
【解析】
A、Ba(OH)2为强碱抑制水的电离,Na2C03为强碱弱酸盐水解促进水的电离;
B、醋酸是弱电解质,pH=4的醋酸中醋酸浓度大于0.0001mol/L,pH=10的NaOH中氢氧化钠浓度为0.0001mol/L,二者等体积混合,醋酸过量;
C、混合溶液中应有电荷守恒关系:c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-);
D、Na2CO3溶液中物料守恒关系为c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)。
A项、水的电离方程式为H2O![]() H++OH-,Ba(OH)2为强碱水的电离,Na2C03为强碱弱酸盐促进水的电离,因此Na2C03溶液中水电离的c(OH-)大,故A错误;
H++OH-,Ba(OH)2为强碱水的电离,Na2C03为强碱弱酸盐促进水的电离,因此Na2C03溶液中水电离的c(OH-)大,故A错误;
B项、醋酸是弱电解质,pH=4的醋酸中醋酸浓度大于0.0001mol/L,pH=10的NaOH中氢氧化钠浓度为0.0001mol/L,二者等体积混合,醋酸过量,醋酸的电离程度大于醋酸根离子水解程度,所以pH<7,故B正确;
C项、溶液遵循电荷守恒的原则,混合溶液中应有c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;
D项、碳酸钠溶液中存在物料守恒,n(Na)=2n(C),0.1molL-1的NaHCO3溶液中离子浓度关系:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故D错误.
故选B。


科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:
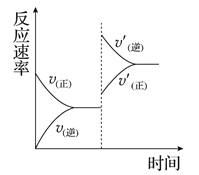
mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将amolH2S和bmolO2混合充分燃烧后,两反应物都没有剩余,得到三种产物(S、SO2和H2O),则下列判断错误的是
A.产生的SO2是(b﹣a/2)mol
B.反应后生成的水质量为18ag
C.反应后氧化产物的总质量为(16a﹣32b)g
D.3a>2b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知:2NO(g)+O2 (g) =2NO2(g) △H1= -113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) △H2= -227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) △H3= -57 kJ/mol
则 2O3(g)= 3O2(g)是_________反应(填“放热”或“吸热”),以上 O3氧化脱除氮氧化物的总反应是NO(g)+O3(g)=NO2(g)+O2(g) △H4=_______kJ/mol,最后将NO2与_________剂反应转化为无污染的气体而脱除。
步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I | 2NO(g) | Ea1 |
|
|
II | N2O2(g)+O2(g) | Ea2 |
|
|
(2)已知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①表中k1、k2、k3、k4是只随温度变化的常数,温度升高将使其数值_____(填“增大”或“减小”)。
②反应I瞬间建立平衡,因此决定2NO(g)+O2(g)![]() 2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
③一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)的速率方程为
2NO2(g)的速率方程为![]() ,则k=_______ (用k1、k2、k3表示)。
,则k=_______ (用k1、k2、k3表示)。
(3)将一定量的 NO2放入恒容密闭容器中发生下列反应:2NO2(g) ![]() 2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有U、V、W、X四种短周期元素,原子序数依次增大,其相关信息如下表:

请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为________,其中心原子采取______杂化。
(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含有________键,属于________晶体。
(3)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有18个电子。乙和丙的化学式分别是________、____________,两者沸点的关系为:乙________丙(填“>”或“<”),原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。

请回答下列问题:
(1)在A中发生的化学反应方程式为_____;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是_____(用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置c中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)若该实验中还需检测产物水蒸气,则应在C装置前添加干燥管,并在其中放置_____试剂。
(4)实验时,装置C中盛放的试剂是_____,现象时_____,可用来验证_____的存在。
(5)装置D中发生的反应方程式为_____,当D中_____现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(填“变大”、“变小”或“不变”)
(2)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式:____。
(3)硬质玻璃管中的反应现象为____,反应的化学方程式为____。
(4)装置中空试管的作用是____。
(5)实验中,观察到紫色石蕊溶液颜色的变化为____。
(6)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为_____。
(7)盛水的试管中,溶液最后的颜色为___,说明氯气____(填“能”或“不能”)溶于水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com