
【题目】有U、V、W、X四种短周期元素,原子序数依次增大,其相关信息如下表:

请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为________,其中心原子采取______杂化。
(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含有________键,属于________晶体。
(3)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有18个电子。乙和丙的化学式分别是________、____________,两者沸点的关系为:乙________丙(填“>”或“<”),原因是______________。
【答案】5∶1 sp2 共价 原子 C2H6 H2O2 < H2O2分子间存在氢键,C2H6分子间不存在氢键
【解析】
根据核外电子排布规律分析解答;根据共价键的形成及分类分析解答;根据分子间作用力的综合利用分析解答;
根据题意已知,U是H元素;V元素三个能级,说明只有2个电子层,且每个能级中电子数相等,它的核外电子排布式为:1s22s22p2,即C元素;W在基态时,2p轨道处于半充满状态,所以它的核外电子排布式为:1s22s22p3,即N元素;X与W同周期,说明X处于第二周期,且X的第一电离能比W小,故X是O元素;
(1) 衡量石油化工发展水平的标志的是乙烯,即甲分子是乙烯分子,乙烯分子中含有碳碳双键,双键中含有一个σ键和一个π键,两个碳氢共价键,即四个σ键,则甲分子中σ键和π键的个数比为:5∶1,其中心原子采取的是sp2杂化,体现平面结构;
(2) V3W4晶体是C3N4晶体,其硬度比金刚石大,说明晶体中含有共价键,是原子晶体;
(3) V的氢化物含有18个电子,该分子是C2H6,W的氢化物含有18个电子的分子是:H2O2,由于H2O2分子间存在氢键,C2H6分子间不存在氢键,故沸点:C2H6<H2O2;


科目:高中化学 来源: 题型:
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题;
(1)在新型纳米催化剂 Na-Fe3O4,和HMCM-22的表面将CO2先转化为烯烃再转化为烷烃,已知CO2转化为CO的反应为CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol;
2 CO2 (g)+6H2(g)=C2H4(g)+4 H2O (g) △H=-128kJ/mol
则CO转化为C2H4的热化学方程式为______________________。
(2)用氨水捕捉烟气中的CO2生成NH4CO3。通常情况下,控制反应温度在35℃-40℃范围内的原因___________。
(3)有科学家提出可利用FeO吸收CO2,6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
2Fe3O4(s)+C(s) K1(平衡常数),对该反应的描述正确的是______
a.生成 1mol Fe3O4时电子转移总数为2NA
b.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
d.恒温恒压下,气体摩尔质量不变可作为平衡的标志
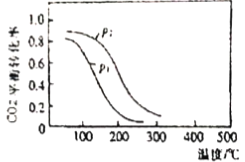
(4)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g) △H,一定条件下,向2L恒容密闭容器中充入1 molCO2和3mo1H2。在不同催化剂作用下发生反应I、反应II、反应II,相同时间内CO2的转化率随温度变化如图所示:

①活化能最小的为___________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)___________v(逆)(填“>”、“=”或“<”)。
③T4温度下该反应的衡常数___________(保留两位有效数字)
④CO2的平衡转化率与温度、压强的关系如图所示:则该反应为___________(放热反应、吸热反应);P1___________P2(填“>”、“=”或“<”)
(5)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废电池屮的铅膏(主要成PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___________(保留两位有效数字):若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为1L的密闭容器中充入2mol A和1![]() B,发生如下反应:
B,发生如下反应:![]() ,5min后反应达到平衡,这时C的浓度为1.2
,5min后反应达到平衡,这时C的浓度为1.2![]() ,请回答:
,请回答:
(1)5min内A消耗速率![]() ________________________________;
________________________________;
(2)能判断该反应达到化学平衡状态的依据是__________________;
A.混合气体的压强保持不变 B.单位时间内生成2molA的同时生成1mol B
C.混合气体的密度保持不变 D.A、B、C的物质的量之比为![]()
(3)该反应的平衡常数表达为K=_______________________,该温度下反应的平衡常数是_________;
(4)B在此条件下的转化率为___________________;
(5)升高温度,混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。

回答下列问题:
(1)写出A、B、C、D的结构简式:
A ____________,B____________C___________,D_____________。
(2)写出①②两步的化学方程式,并注明反应类型:
①__________________________________(反应类型________________)。
②_________________________________(反应类型________________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D、E、X、Y、Z是周期表中的前20号元素,且原子序号逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、直线形、折线形、直线形,回答下列问题:
(1)E的氢化物的电子式为_____,D的氢化物分子中键角为_____,Y的氢化物的结构式为_____,X的氢化物沸点_____Z的氢化物沸点(填“高于”或“低于”)。
(2)D和Y形成的化合物,其分子的电子式为_____,空间构型为_____形,为_____(填“极性”或“非极性”)分子。
(3)取上述五种氢化物中的两种化合,能生成一种含有离子键、共价键和配位键的化合物,试写出其中的任意一种的化学式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
B. 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C. 将0.2 molL﹣1NaA溶液和0.1 molL﹣1盐酸溶液等体积混合所得碱性溶液中c(Na+)+c(H+)=c(A﹣)+c(Cl﹣)
D. 0.1 molL﹣1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,22.4L的37Cl2中所含的中子数为20NA
B. 标准状况下,8.0g甲烷所含C一H键数目为2.0NA
C. 若将1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
D. 一定条件下,0.1molN2与足量H2充分反应,生成NH3分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲氧基肉桂酸异辛酯是目前世界上最常用的防晒剂之一,具有极高的紫外光吸收率,安全性良好,毒性极小,因此广泛应用于日用化工、塑料、橡胶和涂料等领域。其合成路线如下:

回答下列问题:
(1)C的化学名称是___________。E中的两种含氧官能团的名称___________、___________。
(2)B为单卤代烃,请写出合成线路中①的反应方程式___________。
(3)写出由C生成D和由D生成E的反应类型___________、___________。
(4)写出合成甲基肉桂酸异辛酯所需的F的结构简式___________。
(5)X与F互同分异构体。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为6:2:1。写出符合上述条件的X的结构简式___________。
(6)巴豆酸乙酯存在于苹果、木瓜、草莓、可可等中,在引发剂的作用下可以生成聚巴豆酸乙酯。请运用所学知识,结合上述合成过程,请写出以乙烯和丙二酸为原料合成聚巴豆酸乙酯 的合成路线(无机试剂可任选)。
的合成路线(无机试剂可任选)。
____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MgCl2+6NH3![]() MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程装置如图,放氨过程实验装置如图。
MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程装置如图,放氨过程实验装置如图。

己知:相关物质的性质见下表

请回答:
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为___________,虚框内装置的作用是___________,氨化过程采用冰水浴的原因可能是___________(填选项序号字母)。
A 氨化过程为吸热反应,促进反应正向进行
B 加快反应速率
C 防止氨气从溶液中挥发,提高氨气利用率
D 增大六氨氯化镁的溶解度
(2)利用MgCl2溶液制备无水MgCl2,其具体操作为______________________。
(3)提纯MgCl2·6NH3操作中,下列洗涤剂最合适的是___________(填选项序号字母)。
A 冰浓氨水 B 乙二醇和水的混合液
C 氨气饱和的甲醇溶液 D 氨气饱和的乙二醇溶液
(4)进行放氨实验时,三颈烧瓶加入1.97 g MgCl2·6NH3和烧碱的浓溶液,加热,并不断通入N2,通入N2目的是___________。通过观察烧杯中现象的变化就可以监控MgCl2·6NH3的放氨过程,若要判断转化率是否达到或超过90%,则烧杯中溶液可以是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com