
【题目】海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁的化工流程图如下:

已知:MgO的熔点为28000C,MgCl2的熔点为1180C。
回答下列问题:
(1)写出在卤水中加入石灰乳生成Mg(OH)2的离子方程式 。
(2)将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳。石灰制成石灰乳的过程
是 反应(填“吸热”或“放热”)
(3)操作A是指 。
(4)写出电解MgCl2制取Mg的化学方程式 。
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?
(填“同意”或“不同意”),请说出你同意或不同意的理由 。
【答案】(1)Ca(OH)2+Mg2+=Mg(OH)2+Ca2+;(2)放热;(3)蒸发结晶;(4)MgCl2(熔融) ![]() Mg+Cl2↑;(5)不同意,因为MgO的熔点很高,熔融时会消耗大量的电能而增加生产成本。
Mg+Cl2↑;(5)不同意,因为MgO的熔点很高,熔融时会消耗大量的电能而增加生产成本。
【解析】
试题分析:(1)Mg(OH)2难溶物质,因此反应方程式为Ca(OH)2+MgCl2=Mg(OH)2+CaCl2;(2)石灰的成分是CaO,石灰乳是Ca(OH)2,CaO+H2O=Ca(OH)2,此反应是放热反应;(3)溶液变为固体,采用的方法的是蒸发结晶;(4)其反应方程式为:MgCl2(熔融) ![]() Mg+Cl2↑;(5)氧化镁的熔点较高,由固体转化成熔融状态时,消耗大量电能增加成本,因此不同意。
Mg+Cl2↑;(5)氧化镁的熔点较高,由固体转化成熔融状态时,消耗大量电能增加成本,因此不同意。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用比表示阿伏加德罗常数的数值,下列说法正确的是( )
A.ILlmol/L的氯化铁溶液中,若C1-的数目为3 NA,则Fe3+的数目为NA
B.1 molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA
C.常温下,1L0.lmol/L的Na2S溶液中阴离子数目大于0.1 NA
D.0.1 mol Cl2通入水中,转移电子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
A.平衡时c(NH3)=5mol/L
B.平衡时HI分解率为20%
C.混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志
D.平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子充数之和是Z的3倍,下列说法正确的是( )
Y | Z | ||
X | W |
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式Ba2++SO42- ===BaSO4↓表示的是
A. 氯化钡和硫酸钠溶液反应 B. 碳酸钡和稀硫酸反应
C. 氢氧化钡和硫酸铝溶液反应 D. 氢氧化钡和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的工艺如下:
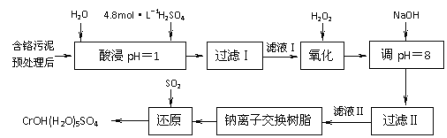
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、 。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式: 。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | —— | —— | —— |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 不慎打翻燃着的酒精灯,应立即用湿抹布盖灭
B. 金属镁着火时应立即用泡沫灭火器灭火
C. 不小心将浓碱液滴到皮肤上,应立即用大量水冲洗,然后涂点稀硼酸溶液
D. 蒸馏实验时如果蒸馏烧瓶中忘加沸石,应立即停止加热,冷却后补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠作为一种重要原料,可用于制造许多在国防工业上有重要用途的金属。下列关于钠的说法不正确的是( )
A. 银白色固体 B. 密度比水大 C. 能与水剧烈反应 D. 可保存在煤油中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com