
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2,则下列结论不正确的是
A.平衡时c(NH3)=5mol/L
B.平衡时HI分解率为20%
C.混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志
D.平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变
【答案】D
【解析】
试题分析:设:碘化铵生成氨气和碘化氢的浓度为x,则
①NH4I(s)![]() NH3(g)+HI(g)
NH3(g)+HI(g)
x x
②2HI(g)![]() H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,即
H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,即
1mol/L 0.5mol/L 0.5mol/L
所以碘化氢的平衡浓度是(x-1)mol/L,根据反应①的平衡常数为20,则x(x-1)=20,解得x=5mol/L;A.由分析可知平衡时c(NH3)=5mol/L,故A正确;B.平衡时HI分解率为![]() ×100%=20%,故B正确;C.反应体系气体的总物质的量始终不变,则混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志,故C正确;D.平衡后缩小容器体积,反应①逆向移动,NH4I的物质的量增加,HI的物质的量降低,反应②逆向移动,则I2的物质的量也减小,故D错误;答案为D。
×100%=20%,故B正确;C.反应体系气体的总物质的量始终不变,则混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志,故C正确;D.平衡后缩小容器体积,反应①逆向移动,NH4I的物质的量增加,HI的物质的量降低,反应②逆向移动,则I2的物质的量也减小,故D错误;答案为D。


科目:高中化学 来源: 题型:
【题目】在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是
A.一定有碘离子 B.可能含铁离子 C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是( )
A. 往自来水中加入明矾进行杀菌消毒
B. 氮化硅陶瓷是一种新型的无机非金属材料
C. 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
D. 为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5:有机化学基础]
制作软质隐形眼镜高分子材料(M)和聚酯PET的合成路线如下:
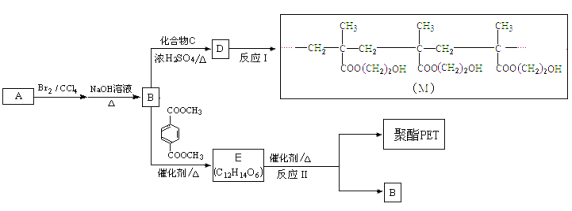
已知酯与醇可发生如下酯交换反应:
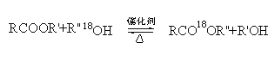 (R、R′、R″ 代表有机基团)
(R、R′、R″ 代表有机基团)
(1)A的相对分子质量是28,A、B分子中含有的官能团分别是 。
(2)B的名称是 。
(3)反应I的反应类型是_______(选填字母)。
a.加聚反应 b.缩聚反应
(4)有关B、C、D的说法正确的是 。
a.1mol B最多可以和1 mol C反应
b.C、D都能使Br2的CCl4溶液褪色
c.D与NaOH溶液共热后可以得到B和C
(5)B→D的化学方程式是 。
(6)C有多种同分异构体,其中一种是合成纤维维尼纶的单体,该分子在酸性环境下水解得到两种产物,它们的相对分子质量相差16,该同分异构体的结构简式是 。
(7)反应II的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质,X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族。
(2)反应①的离子方程式为 反应②的离子方程式为 反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 ,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
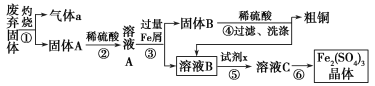
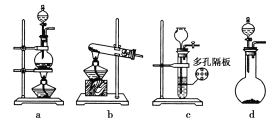
(1)③④操作中会有一种气体生成,若在实验室制备该气体,可选择下列哪些装置________。
(2)溶液B加稀硫酸酸化后加强氧化剂x,试剂x最好选择下列哪种试剂________(填序号)。
a.Cl2 b.H2O2 c.KMnO4
试剂x在酸性条件下与溶液B反应的离子方程式为_____________________________________。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
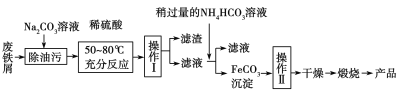
操作II的的名称是 ;
写出在空气中煅烧FeCO3的化学方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) △H<0。
CH3OH(g) +H2O(g) △H<0。
可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B.v正(CO2)=3v逆(H2)
C.容器内混合气体平均相对分子质量保持不变
D.容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品。从海水中制取金属镁的化工流程图如下:

已知:MgO的熔点为28000C,MgCl2的熔点为1180C。
回答下列问题:
(1)写出在卤水中加入石灰乳生成Mg(OH)2的离子方程式 。
(2)将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳。石灰制成石灰乳的过程
是 反应(填“吸热”或“放热”)
(3)操作A是指 。
(4)写出电解MgCl2制取Mg的化学方程式 。
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?
(填“同意”或“不同意”),请说出你同意或不同意的理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,若使pH=3的盐酸与pH=9的Ba(OH)2溶液混合使其成为pH=7的溶液,混合时盐酸和Ba(OH)2溶液的体积比为
A.1∶60 B.3∶1
C.1∶100 D.100∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com