
【题目】实验室常用以下方法制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
(1)用双线桥标出电子转移方向和数目 .
(2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为 , 被氧化HCl的质量为 .
(3)为保证实验安全,常用NaOH溶液吸收多余的氯气.
①写出反应的离子方程式;
②当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2molL﹣1的NaOH溶液的体积至少应为多少?(写出计算过程)
【答案】
(1)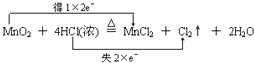
(2)2mol;36.5g
(3)
①Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
②4分钟时n(Cl2)= ![]() ×4=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
×4=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)= ![]() =0.2L=200mL,
=0.2L=200mL,
答:NaOH溶液的体积至少应为200mL.
【解析】解:(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O反应中锰元素化合价变化:+4→+2,氯化氢中部分氯元素化合价变化:﹣1→0,消耗1mol二氧化锰,转移4mol电子,用双线桥表示为:
MnCl2+Cl2↑+2H2O反应中锰元素化合价变化:+4→+2,氯化氢中部分氯元素化合价变化:﹣1→0,消耗1mol二氧化锰,转移4mol电子,用双线桥表示为: 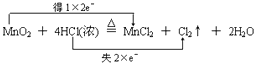 ,所以答案是:
,所以答案是: 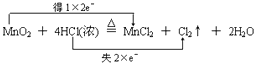 ;(2)标况下11.2LCl2的物质的量为
;(2)标况下11.2LCl2的物质的量为 ![]() =0.5mol,此反应中HCl和Cl2的化学计量数之比为4:1,则参加反应的HCl的物质的量为0.5mol×4=2mol,反应中被氧化的HCl为参加反应HCl的物质的量的
=0.5mol,此反应中HCl和Cl2的化学计量数之比为4:1,则参加反应的HCl的物质的量为0.5mol×4=2mol,反应中被氧化的HCl为参加反应HCl的物质的量的 ![]() ,则被氧化HCl的物质的量为2mol×
,则被氧化HCl的物质的量为2mol× ![]() =1mol,质量为1mol×36.5g/mol=36.5g;所以答案是:2mol;36.5g.(3)①氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
=1mol,质量为1mol×36.5g/mol=36.5g;所以答案是:2mol;36.5g.(3)①氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
【考点精析】利用氯气的实验室制法对题目进行判断即可得到答案,需要熟知实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅,但比原来要深
B. 高压比常压有利于SO2合成SO3的反应
C. 500 ℃时比室温更利于合成氨
D. 氯水在光照条件下颜色变浅,最终变为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒,在溶液中能大量共存的是( )
A. Ca2+、Cl﹣、CO32-、K+ B. Cu2+、Cl﹣、SO42-、OH﹣
C. K+、Cl﹣、NO3-、H+ D. H+、Cl﹣、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用碳及其化合物的性质,完成下列小题:
(1)长期存放石灰水的瓶子内会出现一层白色固体,请分析这层白色固体产生的原因(用化学方程式表示);用完石灰水后,怎样除去瓶壁上的白色固体,(用化学方程式表示).
(2)除去碳酸钠固体中少量碳酸氢钠的方法是(用化学方程式表示):
(3)向碳酸氢钠溶液滴加NaOH溶液,发生反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,铁元素被氧化的是( )
A.FeS +2HCl = FeCl2 + H2S↑ B.Fe +H2SO4 = FeSO4 +H2↑
C.FeO + 2HCl =FeCl2 +H2O D.2FeCl3 +Cu = 2FeCl2 + CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L H2O含有的分子数为NA
B.2L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
C.常温下,NA个CO2分子占有的体积为22.4L
D.1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知 l00mL 某无色溶液 X 可能由K+、Mg2+、Ba2+、Al3+、Fe2+、AlO2-、CO32- 、SO42-、I-、SiO32-、MnO4-中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成:
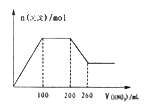
I .取适量该溶液,加入过量1.0 mol·L-1的硝酸,有气体生成,并得到无色溶液。该过程中产生沉淀的物质的量与加入的硝酸溶液体积的关系如上图所示。
II.将I过滤,在所得滤液中再加入过量的碳酸氢铵溶液,有气体生成,析出白色沉淀A;
III.在II所得溶液中逐滴加入氢氧化钡溶液至过量,加热有气体生成,同时析出白色沉淀B;
IV.向沉淀B中加入过量稀盐酸,沉淀部分溶解,将剩余沉淀过滤、洗涤、干燥后称重为 2.33 克,
根据以上实验事实推断:
(1)原溶液中一定含有的离子是___________________________。
(2)上述实验步骤II中产生白色沉淀A的离子方程式是________________________。
(3)白色沉淀B的成分是______________________________。
(4)原溶液中阳离子物质的量浓度为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com