
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到化学平衡的标志是( )
2AB(g)达到化学平衡的标志是( )
A. 容器内A2、B2、AB三种气体的浓度相等
B. 单位时间内有xmol A2生成,同时就有xmol B2生成
C. 单位时间内有xmol A2被消耗,同时就有2xmol AB生成
D. 单位时间内有xmol B2发生反应,同时就有2xmol AB被分解
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种仿生高聚物(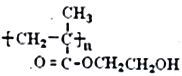 )的单体。由化合物A(C4H8)制备H的一种合成路线如下:
)的单体。由化合物A(C4H8)制备H的一种合成路线如下:
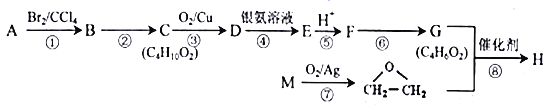
已知:A与M互为同系物。回答下列问题:
(1)A的系统命名为_____________。D分子中含有的官能团名称为__________________。
(2)F→G的反应条件为______________________。反应②、⑦的反应类型分别为_________、_________。
(3)反应⑧的化学方程式为___________________________________。
(4)化合物X为H的同分异构体,X能与新制的氢氧化铜悬浊液反应生成砖红色沉淀,还能与Na2CO3饱和溶液反应放出气体,其核磁共振氢谱有4种峰。写出两种符合要求的X的结构简式_____________________________________________________。
(5)根据上述合成中的信息,试推写出以乙烯、乙酸为原料经三步制备CH3-COOCH=CH2的合成路线_______________________________________(其他试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为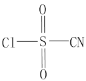 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为__________,组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为__________
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是__________、__________, 1个氯磺酰氰酯分子中含有σ键的数目为__________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为__________。
(3)ClO4-的空间构型为__________
(4)一种由铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为__________
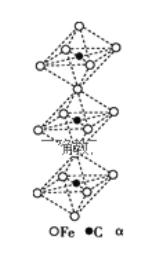
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(N)= 6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移2 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列混合物的分离或提纯,应选用下述方法的哪一种?________(填序号)
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.灼热氧化 G.加热分解
① 分离CC14和H2O_______ ② 从碘水中提取碘________
③ 分离酒精和水的混合物______ ④ 除去NaCl中所含的少量KNO3________
⑤ 除去澄清石灰水中悬浮的CaCO3__________⑥ 分离固体NH4Cl和NaCl________
Ⅱ. 现实验室需用质量分数为98%、密度为1.84g.cm﹣3的浓硫酸的体积配制450 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管,②烧瓶,③烧杯,④药匙,⑤量筒,⑥托盘天平。
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的B和__________(填字母)。

(2)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(3)经计算,配制450 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL。
(4)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因__________(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
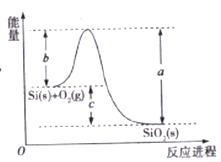
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图或曲线图与对应的叙述相符的是
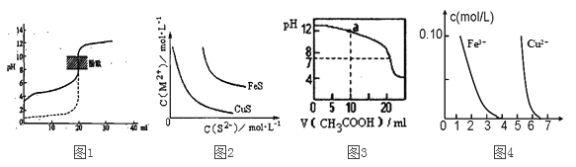
A. 如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
B. 某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+
C. 如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+)
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置(固定、加热仪器和橡胶管略)进行有关氨制取的实验探究。回答下列问题:
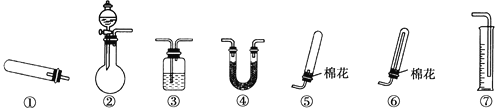
(1)若用装置①制取NH3,其反应的化学方程式为__________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂可能是__,分液漏斗中装的试剂可能是________,收集装置应选择________(填装置序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A开始有如下图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
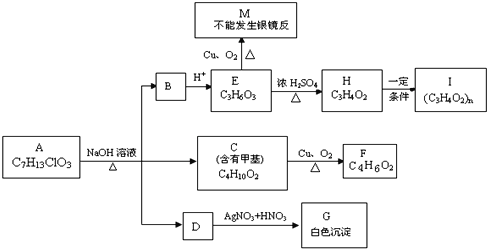
(1)A可能的结构简式:_______________________________________________;
(2)写出反应类型: E→H_________________、H→I__________________;
(3)写出C→F的化学方程式:__________________________。
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图_______(有机物用结构简式表示,必须注明反应条件)。提示:合成过程中无机试剂任选。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com