
【题目】某同学用下图所示装置(固定、加热仪器和橡胶管略)进行有关氨制取的实验探究。回答下列问题:
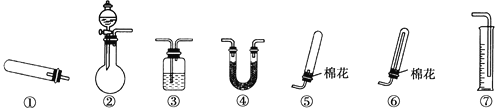
(1)若用装置①制取NH3,其反应的化学方程式为__________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________。
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂可能是__,分液漏斗中装的试剂可能是________,收集装置应选择________(填装置序号)。
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O ③⑦ 氨难溶于该试剂,该试剂不易挥发,且该试剂不与氨反应 CaO(或NaOH或碱石灰) 浓氨水 ⑥
2NH3↑+CaCl2+2H2O ③⑦ 氨难溶于该试剂,该试剂不易挥发,且该试剂不与氨反应 CaO(或NaOH或碱石灰) 浓氨水 ⑥
【解析】
装置①为固体加热反应装置,故由此制取NH3,反应物为氯化铵和氢氧化钙; 装置②为固液不加热装置,③为气体收集装置,原理为排液法,④为干燥U型管,⑤⑥为收集装置,原理为排空气法,⑦主要用于测量液体体积。
(1)若用装置①制取NH3,其反应的化学方程式为2NH4Cl+Ca(OH)2 △CaCl2+2NH3↑+2H2O;若要测定生成的NH3的体积,则必须选择的装置是③⑦,氨气从短口进,将液体从长口排出进入量筒中,通过排出液体的体积测量收集氨气的体积。装置中所盛试剂不能干扰氨气的收集,不能引入杂质,应具有的性质是:氨难溶于该试剂,该试剂不易挥发,且该试剂不与氨反应。
(2)若用装置②制取并收集干燥的NH3,由于氧化钙可与水反应,反应放热(或氢氧化钠溶于水放热),使溶液中c(OH-)增大的同时,促使NH3·H2O的分解生成氨气,故烧瓶内装的试剂可能是CaO(或NaOH或碱石灰),分液漏斗中装的试剂可能是浓氨水,氨气密度小于空气,收集装置应选择⑥。


科目:高中化学 来源: 题型:
【题目】I.(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①假设用酸性高锰酸钾溶液吸收煤燃烧产生的SO2,该过程中高锰酸根被还原为Mn2+,请写出该过程的离子方程式______________。
②将燃煤产生的二氧化碳加以回收,可降低碳的排放。左图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图,a电极名称:_____________(填“正极”或“负极”),b电极的反应式:________________________。

(2)如果采用NaClO、Ca(ClO)2作吸收剂,也能得到较好的烟气脱硫效果。
已知下列反应:
SO2(g)+2OH-(aq) ==SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq) ==SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)==Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO-(aq) +2OH-(aq) = CaSO4(s) +H2O(l) +Cl-(aq)的ΔH=_____。
II.(3)FeO42-在水溶液中的存在形态如图所示。

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是__________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,_________转化为_________(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到化学平衡的标志是( )
2AB(g)达到化学平衡的标志是( )
A. 容器内A2、B2、AB三种气体的浓度相等
B. 单位时间内有xmol A2生成,同时就有xmol B2生成
C. 单位时间内有xmol A2被消耗,同时就有2xmol AB生成
D. 单位时间内有xmol B2发生反应,同时就有2xmol AB被分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是

A. 电子从b流出,经外电路流向a
B. HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-=SO42-+9H+
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂的操作方法,正确的是( )
A. CO2中混有少量SO2:通过装有NaOH溶液的洗气瓶
B. NO中混有少量NO2气体:用水洗涤后再干燥
C. 食盐中混有少量NH4Cl:加过量NaOH溶液后加热蒸干
D. 硝酸混有少量硫酸:加适量BaCl2后再过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述正确的是
A. 中和滴定实验中指示剂不宜加入过多,通常控制量在1 mL ~2mL
B. 用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C. 用量筒量取5.00mL1.00mol·L-1 盐酸
D. 中和滴定实验中的锥形瓶用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
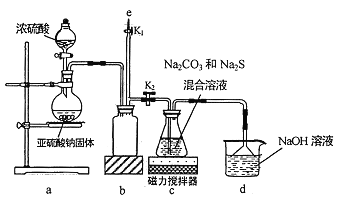
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转。结构简式为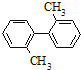 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )
A. 分子中最多有16个原子处于同一平面上
B. 该烃的一氯代物最多有4种
C. 该烃是苯的同系物
D. 分子中至少有9个碳原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:

已知:① (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)J的名称为____________。E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为______________________________________________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:_________________________________________________。
)的合成路线:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com