
分析 (1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,加入铁粉可防止Fe2+离子被氧化为Fe3+离子;
(2)莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解;
(3)根据Fe2+水解,NH4+水解以及物质的化学式来解答;
(4)根据Kw计算溶液中c(OH-),根据电荷守恒计算溶液中c(NH4+),根据物料守恒计算溶液中c(NH3•H2O),溶液中存在平衡:NH4++H2O?NH3•H2O+H+,代入平衡常数表达式计算,氨水中存在下列的电离平衡:NH3•H2O?NH4++OH-,结合水的电离平衡来解答.
解答 解:(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
故答案为:防止Fe2+被氧化为Fe3+;
(2)莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者,
故答案为:大于;
(3)Fe2+水解,NH4+水解,溶液呈酸性,两者的浓度降低,溶液中离子浓度由大到小的顺序为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
故答案为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
(4)常温下,若0.10 mol•L-1(NH4)2SO4溶液的pH=5,溶液中c(H+)=10-5mol•L-1,故溶液中c(OH-)=10-9mol•L-1,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol•L-1=10-9mol•L-1+0.20 mol•L-1,则c(NH4+)=(0.20+10-9-10-5)mol•L-1,根据物料守恒计算溶液中c(NH3•H2O)=0.20mol•L-1-(0.20+10-9-10-5)mol•L-1=(10-5-10-9)mol•L-1,故NH4++H2O?NH3•H2O+H+的平衡常数的表达式为Kh=$\frac{[N{H}_{3}•{H}_{2}O][{H}^{+}]}{[N{{H}_{4}}^{+}]}$=$\frac{1{0}^{-5}(1{0}^{-5}-1{0}^{-9})}{0.20+1{0}^{-9}-1{0}^{-5}}$=5×10-10,氨水中存在下列的电离平衡:NH3•H2O?NH4++OH-,电离平衡常数为K,水的电离平衡可知:Kh=$\frac{[N{H}_{3}•{H}_{2}O][{H}^{+}]}{[N{{H}_{4}}^{+}]}$$\frac{[O{H}^{-}]}{[O{H}^{-}]}$=Kw×$\frac{1}{{K}_{b}}$,
5×10-10×K=1×10-14,所以K=2×10-5,
故答案为:2×10-5 ;
点评 本题考查了盐类水解、电解质溶液中电荷守恒、物料守恒的分析应用,掌握基础是关键,题目难度中等.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:解答题
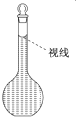 实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
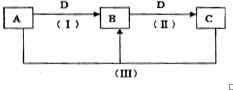 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
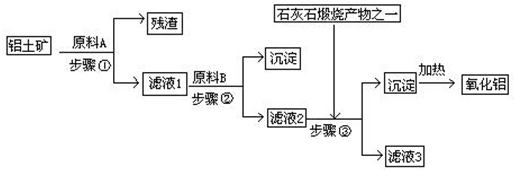
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则 H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 葡萄糖的燃烧热是2800 kJ•mol-1,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则 2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是 CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1,则 CH3OH(g)的燃烧热为 192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
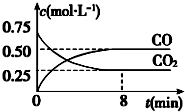 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com