
 .
.分析 (1)盐酸的物质的量浓度=$\frac{10{\;}^{3}ρω}{M}$;
(2)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,标出电子的转移方向和数目;
(3)KMnO4为氧化剂,HCl为还原剂,结合化合价的变化或方程式计算;
(4)根据方程式知,参加反应的HCl有$\frac{5}{8}$被氧化,结合化合价的变化计算.
解答 解:(1)盐酸的物质的量浓度=$\frac{10{\;}^{3}ρω}{M}$=$\frac{10{\;}^{3}×1.2×36.5%}{36.5}$mol/L=12mol/L,故答案为:12mol/L;
(2)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,可表示为 ,
,
故答案为: ;
;
(3)KMnO4为氧化剂,HCl为还原剂,由2KMnO4~10HCl可知氧化剂与还原剂的物质的量之比为2:10=1:5,故答案为:1:5;
(4)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:$\frac{5}{8}$,15.8g (即0.1mol)KMnO4完全反应时,产生的Cl2为0.25mol,转移电子0.5mol,数目为0.5NA,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,
故答案为:5.6L;0.5NA;
点评 本题考查氧化还原反应的计算,明确方程式中各个物理量之间的关系式是解本题关键,侧重考查计算能力,注意参加反应的HCl有一部分被氧化,为易错点.


科目:高中化学 来源: 题型:解答题
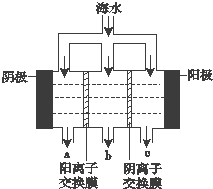 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
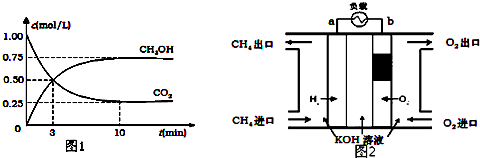
| A. | CH3OH的燃烧热为192.9 kJ/mol | |
| B. | CH3OH转变成H2的过程不一定要吸收能量 | |
| C. | 根据①②推知反应:H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.9 kJ/mol | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
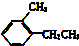 ②
② ③
③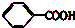 ④TNT
④TNT查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量比为8:3 | |
| B. | 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2:3 | |
| C. | 生成1molNO气体转移的电子数为3NA | |
| D. | 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>H2SiO3 | ||
| C. | 碱性:NaOH>LiOH | D. | 热稳定性:HF>HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com