
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。


如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32-
C. 图象中a点的酸的总浓度大于b点酸的总浓度
D. 图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
【答案】D
【解析】A.醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;B.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;C.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故C错误;D.在![]() 的分子、分母同时乘以氢离子浓度可得:
的分子、分母同时乘以氢离子浓度可得:![]() ,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故D正确;故选D。
,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故D正确;故选D。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢 D. 空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2SO2(g)+ O2(g)= 2SO3(g) △H =-196.6kJ·mol-1
2NO(g)+O2=2NO2(g) △H =-113.0kJ·mol-1
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的△H = __________。
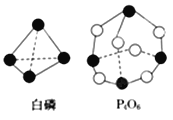
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198kJ·mol-1、E(P-O)=360kJ·mol-1、E(O=O)=498kJ·mol-1,则反应P4(白磷)燃烧生成P4O6的热化学方程式为:___________________。
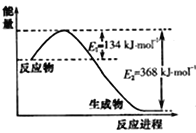
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和 CO反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素镓(Ga)的原子结构示意图是: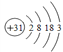 ,下列关系不正确的是
,下列关系不正确的是
A. 原子半径: K > Ga > Al
B. 碱性: KOH > Ga(OH)3 > Al(OH)3
C. 离子的氧化性: K + > Ga3+ > Al3+
D. 与水反应的剧烈程度: K > Ga > Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
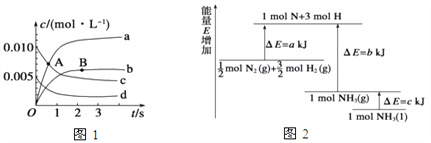
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10s,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g) ![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__________。
(2)为提高水浸速率,可采取的措施为_________(任写一条)。“浸渣”的主要成分为________。
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是_________(填字母代号)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为________________。
(5)流程中可以循环利用的物质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁一次氯酸钠热料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2
B. 图乙中惰性电极棒上有02放出
C. 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
D. 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com