
【题目】有A、B、C、D四种烃,在常温下A、C是常见气体,B、D是液体。
①A完全燃烧后生成二氧化碳与水的物质的量之比是2:1;
②B的相对分子质量是A的三倍;
③C在光照条件下最多可与六倍于其体积的氯气发生反应,C不能使酸性高锰酸钾溶液褪色;
④燃烧相同物质量的C与D,生成二氧化碳的体积比为1:4,D不能使溴水因反应而褪色但能使酸性高锰酸钾溶液褪色;在镍催化作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。
试推断A、B、C、D各是什么物质,按要求填写下列各项:
A的电子式____________________ B的分子____________________
C的最简式____________________ D的名称____________________
【答案】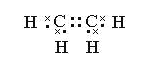 C6H6 CH3CH3 对二甲苯
C6H6 CH3CH3 对二甲苯
【解析】
有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体,A完全燃烧后生成二氧化碳与水的物质的量之比是2:1,则A分子中碳原子与氢原子数目之比为1:1,A为C2H2;B的分子量是A的三倍且液体,B为苯;C不能使酸性高锰酸钾溶液褪色,为饱和烃,但在光照条件下最多可与六倍体积氯气发生反应,分子中含有6个氢原子,C为乙烷;燃烧相同物质的量的C与D,生成二氧化碳的体积比为1:4,D分子中含有8个碳原子,D不能使溴水因反应而褪色,不含不饱和键,在镍的催化作用下1molD能与3mol氢气完全反应,说明含有1个苯环,能使酸性高锰酸钾溶液褪色,属于苯的同系物,在铁粉存在下与溴反应生成一溴代物只有一种,D为对二甲苯。
有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体,A完全燃烧后生成二氧化碳与水的物质的量之比是2:1,则A分子中碳原子与氢原子数目之比为1:1,A为C2H2;其电子式为![]() ;
;
B的分子量是A的三倍,B为苯,结构简式为![]() ;
;
C不能使酸性高锰酸钾溶液褪色,为饱和烃,但在光照条件下最多可与六倍体积氯气发生反应,分子中含有6个H原子,C为乙烷,结构简式为CH3CH3;
燃烧相同物质的量的C与D,生成二氧化碳的体积比为1:4,D分子中含有8个碳原子,D不能使溴水因反应而褪色,不含不饱和键,在镍的催化作用下1mol D能与3mol氢气完全反应,说明含有1个苯环,能使酸性高锰酸钾溶液褪色,属于苯的同系物,在铁粉存在下与溴反应生成一溴代物只有一种,D为对二甲苯,结构简式为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有_____________。
A.v(H2)= 2 v(CO)
B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如下图所示。


①合成甲醇的反应为___________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。P1和P2的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为______L。
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如下图所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种实验装置的有关用法,其中正确的是
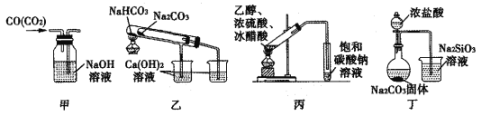
A.甲装置:可用来除去CO气体中的CO2气体
B.乙装置:可用来验证NaHCO3和Na2CO3的热稳定性
C.丙装置:可用来实验室制备乙酸乙酯
D.丁装置:可用来比较HC1、H2CO3和H2SiO3的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置能完成相应实验的是( )
A.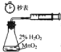 装置测定化学反应速率
装置测定化学反应速率
B.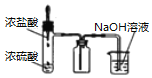 装置制取并吸收HCl
装置制取并吸收HCl
C.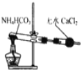 装置制备纯净NH3
装置制备纯净NH3
D.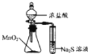 装置比较MnO2、Cl2、S 的氧化性
装置比较MnO2、Cl2、S 的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
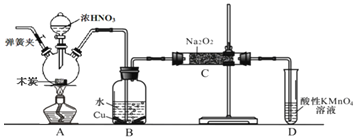
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是
A.②>①>④>③B.④>③>②>①
C.①>②>④>③D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为____________mol。
③该反应中,还原剂为_____________(填化学式),氧化产物与还原产物的质量比为______________。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________________________。
(3)还可利用ClO2消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
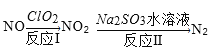
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为______,反应中若生成22.4L N2(标准状况),则消耗ClO2______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/°C | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若平衡浓度符合下列关系式:![]() ,则此时的温度为1 000 °C
,则此时的温度为1 000 °C
D.在1L的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830°C,此时测得CO为0.4 mol,则该反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com