
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
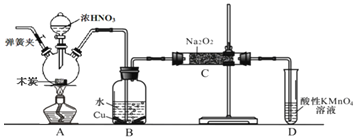
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
【答案】D
【解析】
装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮、二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜、一氧化氮和水;最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
A.若将B中药品换成NaOH溶液,二氧化氮与氢氧化钠反应,没有NO放出,故A错误;
B.因为一氧化氮中混有二氧化碳和水蒸气,二氧化碳和过氧化钠发生反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠和氧气,在B、C装置间增加一个盛放无水![]() 的干燥管,只能除去NO中的水,无法除去二氧化碳,故B错误;
的干燥管,只能除去NO中的水,无法除去二氧化碳,故B错误;
C.由于实验过程中有一氧化氮产生,所以要将装置中的空气全部排尽,再进行实验,实验结束时应先熄灭酒精灯,再停止通入![]() ,可以防止倒吸等意外事故的发生,故C错误;
,可以防止倒吸等意外事故的发生,故C错误;
D.酸性条件下,NO能与![]() 反应生成
反应生成![]() 和
和![]() ,D装置用于尾气处理,标况下,
,D装置用于尾气处理,标况下,![]() LNO的物质的量等于
LNO的物质的量等于![]() mol,根据得失电子守恒,消耗的高锰酸钾为
mol,根据得失电子守恒,消耗的高锰酸钾为![]() mol,故D正确;
mol,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知:2M(g)![]() N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )

A.a、b、c、d四个点中处于平衡状态的点是a、b、d
B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN
C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
D.若40min后出现如图所示变化,则可能是加入了某种催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见下图。

下列说法不正确的是
A.NaNO2的稳定性大于NH4NO2
B.NaNO2与N2H4反应,NaNO2是氧化剂
C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2
D.NaN3分解,每产生1 molN2转移6 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品.一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如下:
![]()

回答下列问题:
(1)A 物质核磁共振氢谱共有 个峰,④的反应类型是 ,C和D中含有的相同官能团的名称是 .
(2)下列试剂中,能和D反应的有 (填标号).
A.溴水 B.酸性K2Cr2O7溶液 C.FeC12溶液 D.纯碱溶液
(3)写出反应①的化学方程式是 (有机物用结构简式表示,下同).
(4)有机物B可由异丁烷经三步反应合成:异丁烷![]() X
X![]() Y
Y![]()
![]() 有机物B条件a为 ,Y生成B的化学方程式为 .
有机物B条件a为 ,Y生成B的化学方程式为 .
(5)呋喃酚的同分异构体很多,写出符合下列条件的所有同分异构体的结构简式
①苯环上的一氯代物只有一种
②能发生银镜反应的芳香酯.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列化学用语的理解正确的是( )
A. 比例模型![]() 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
B. 电子式![]() H既可以表示烃基,也可以表示氢氧根离子
H既可以表示烃基,也可以表示氢氧根离子
C. 丙烯的最简式可表示为CH2
D. 结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种烃,在常温下A、C是常见气体,B、D是液体。
①A完全燃烧后生成二氧化碳与水的物质的量之比是2:1;
②B的相对分子质量是A的三倍;
③C在光照条件下最多可与六倍于其体积的氯气发生反应,C不能使酸性高锰酸钾溶液褪色;
④燃烧相同物质量的C与D,生成二氧化碳的体积比为1:4,D不能使溴水因反应而褪色但能使酸性高锰酸钾溶液褪色;在镍催化作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。
试推断A、B、C、D各是什么物质,按要求填写下列各项:
A的电子式____________________ B的分子____________________
C的最简式____________________ D的名称____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据以上信息推断以下说法正确的是( )
CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据以上信息推断以下说法正确的是( )

A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.此反应达到1 000 ℃时的反应速率比700 ℃时大
D.该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。

回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ 。(已知:完全沉淀后离子浓度低于1×l0-5) mol/L)
④“滤渣2”的主要化学成分为 _______。
⑤“沉锂”过程中加入的沉淀剂为饱和的 __________(化学式)溶液;该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“ ___________”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________。
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6![]() LixC6+Li1-xCoO2其工作原理如图2。
LixC6+Li1-xCoO2其工作原理如图2。
下列关于该电池的说法正确的是___________(填字母)。
A.过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com