
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是
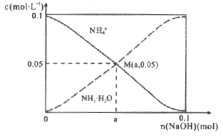
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
【答案】C
【解析】A.M点是向1L0.1mol/LNH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,A正确;B.在M点时溶液中存在电荷守恒,n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(OH-)-n(H+)=0.05+n(Na+)-n(Cl-)=(a-0.05)mol,B正确;C.铵根离子水解显酸性,结合水解平衡常数分析,c(H+)×c(NH3·H2O)/c(NH4+)×c(NH3·H2O)=Kh/c(NH3·H2O),随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则c(H+)/c(NH4+)减小,C错误;D.向1L0.1mol/LNH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.1mol时,恰好反应生成氯化钠和一水合氨,根据物料守恒可知溶液中c(Na+)=c(NH4+)+c(NH3·H2O),D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是( )
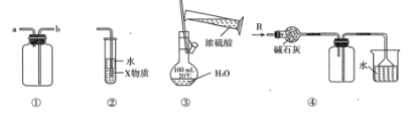
A.装置①可用于收集H2、CO2气体
B.装置②中X若为四氯化碳,则此装置可用于吸收氯化氢,并防止倒吸
C.装置③可用于实验室配制一定物质的量浓度的稀硫酸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
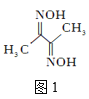
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)基态Ni原子的价电子排布式是___。
(2)丁二酮肟(结构简式如图1所示)中碳原子的杂化方式为___。丁二酮肟中C、N、O第一电离能由大到小的顺序为___。1mol丁二酮肟分子中含有σ键的数目为___mol。
(3)Ni(CO)4是一种无色液体,与CO互为等电子体的二价阴离子的电子式为___。
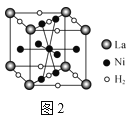
(4)图2是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金含有Ni的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
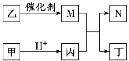
A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的基态原子的核外电子有3种能量状态、5种空间状态,X是其中第一电离能最小的元素;元素Y的M层电子运动状态与X的价电子运动状态相同;元素Z位于第四周期,其基态原子的2价阳离子M层轨道全部排满电子。
(1)X基态原子的电子排布式为___________。
(2)X的氢化物(H2X)在乙醇中的溶解度大于H2Y,其原因是___________。
(3)在Y的氢化物(H2Y分子中,Y原子轨道的杂化类型是___________。
(4)Y与X可形成YX32-。
①YX32-的立体构型为___________(用文字描述)。
②写出一种与YX32-互为等电子体的分子的化学式___________。
(5)Z的氯化物与氨水反应可形成配合物[Z(NH3)4(H2O)2]Cl2,该配合物加热时,首先失去配离子中的配体是___________(写化学式)。
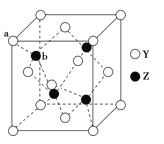
(6)Y与Z所形成化合物晶体的晶胞如图所示,该化合物的化学式为___________。其晶胞边长为540.0pm,密度为___________g·cm-3(列式并计算),a位置Y与b位置Z之间的距离为___________pm(列式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示吸热反应、置换反应、氧化还原反应之间的关系,从下列选项反应中选出属于区域V的是( )
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2↑D.2Na+2H2O=NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是
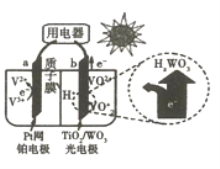
A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 光照时,b极反应为VO2++2OH--e-=VO2++H2O
D. 夜间无光照时,a电极流出电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com