
【题目】如图表示吸热反应、置换反应、氧化还原反应之间的关系,从下列选项反应中选出属于区域V的是( )
![]()
A.Na2O2+2CO2=Na2CO3+O2B.NaOH+HCl=NaCl+H2O
C.2NaHO3=2Na2CO3+H2O+CO2↑D.2Na+2H2O=NaOH+H2↑
【答案】A
【解析】
因为置换反应一定是氧化还原反应,有的氧化还原反应吸热、有的氧化还原反应放热,所以左边的大椭圆是吸热反应,右边的大椭圆为氧化还原反应,右边大椭圆中的小椭圆为置换反应。Ⅰ区为非氧化还原反应中的吸热反应;Ⅱ区为吸热、不属于置换反应的氧化还原反应;Ⅲ区为既属于置换反应、又属于氧化还原反应的吸热反应;Ⅳ区为既属于置换反应、又属于氧化还原反应的放热反应;Ⅴ区为放热的、不属于置换反应的氧化还原反应。
A. Na2O2+2CO2=Na2CO3+O2反应为放热的、不属于置换反应的氧化还原反应,A符合题意;
B. NaOH+HCl=NaCl+H2O反应为非氧化还原反应,B不合题意;
C. 2NaHO3=2Na2CO3+H2O+CO2↑反应为非氧化还原反应,C不合题意;
D. 2Na+2H2O=NaOH+H2↑为放热的、属于置换反应的氧化还原反应,D不合题意。
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,不是氧化还原反应的是 ( )
①H2+Cl2![]() 2HCl
2HCl
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤2HgO![]() 2Hg+O2↑
2Hg+O2↑
A.②④B.①③C.①②③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是
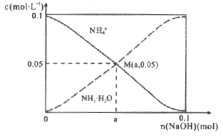
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaC1晶体,相应的实验过程如下:
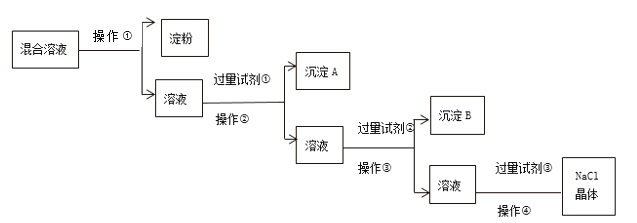
(1)操作①是利用胶体不能通过___________而把淀粉胶体和溶液进行分离。
(2)写出上述实验过程中所用试剂的化学式:试剂①____________;试剂③___________。
(3)判断试剂①已过量的操作是______________________。
(4)操作④的名称是____________。
(5)试剂的作用(用离子方程式表示):__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32+、Cu2+、Ba2+和Na+,探究小组为了确定该溶液中离子的组成,取该溶液100mL进行实验。
步骤 | 实验操作及现象 | 实验结论 | 判断理由 |
I | 加入过量NaOH溶液,生成蓝色沉淀 | 肯定有Cu2+,肯定无____ | 肯定无该离子的理由:_____________ |
II | 将生成的蓝色沉淀过滤、洗涤,灼烧得到24.0g黑色固体。 | Cu2+的物质的量浓度为__ | Cu元素守恒 |
III | 向Ⅱ所得滤液中加入足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的白色沉淀。 | 肯定有Cl-和__肯定无Ba2+ | 肯定有Cl-的理由:______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、( NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,现象和有关数据如图所示(气体体积数据换算成标准状况)。关于该固体混合物,下列说法正确的是( )
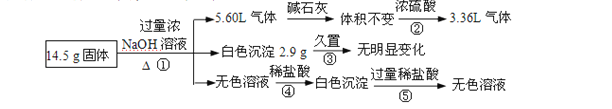
A.含有4.5gAl
B.不含FeCl2、AlCl3
C.含有物质的量相等的( NH4)2SO4和MgCl2
D.含有MgCl2、FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属冶炼产生的废弃物中,常含有砷元素(与磷同主族),由于有毒需检测与处理。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
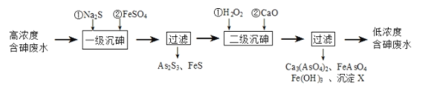
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为___;砷酸的第一步电离方程式为__。
(2)“一级沉砷”中FeSO4的作用是___。
(3)“二级沉砷”中H2O2与含砷物质反应的化学方程式为___。沉淀X为___(填化学式)。
Ⅱ.强阴离子交换柱可以吸附以阴离子形态存在的As(V)达到去除As的目的。采用该方法去除水体中的砷时,可选用NaClO将As(Ⅲ)转化为As(V)。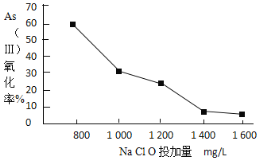
已知:一定条件下,As(V)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO4 | HAsO42 | HAsO42、AsO43 |
(4)pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是___。
Ⅲ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成(即未能检出)。
(5)请写出步骤2的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2﹣甲基丙烯酰氯在一定条件下反应制得:
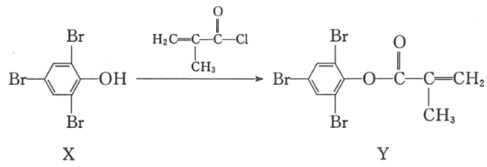
下列有关X、Y的说法正确的是( )
A.X分子中所有原子一定在同一平面上
B.Y与Br2的加成产物分子中含有手性碳原子
C.X、Y均不能使酸性高锰酸钾溶液褪色
D.可以用FeCl3溶液鉴别X和Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com