
科目:高中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
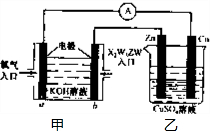 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)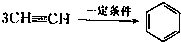 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省五校高三第一次联考化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大。A原子无中子, B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲< 乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等。元素F形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:

(1)A2D的熔沸点比A2G高的原因是 。B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 。
(2)E4B3和水反应的化学方程式 。
(3)写出M与甲的浓溶液加热时反应的化学方程式 。
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(5)已知CH4 (g)+ 2O2 (g)=CO2 (g)+2H2O (l) △H1=a kJ/mol
欲计算反应CH4 (g)+ 4NO (g)=2N2 (g)+CO2 (g)+2H2O (l)的焓变△H2 , 则还需要查找某化合反应的焓变△H3,当反应中各物质化学计量数之比为最简整数比时 △H3 = b kJ/mol,则该反应的热化学方程式为 。
据此计算出△H2 = kJ/mol(用含a和b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省宁德市高三毕业班质量检查化学试卷 题型:填空题
(11分)
X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X、Q同主族,X元素的原子半径最小,Y元素原子的最外层电子数是内层电子数的2倍,Z元素的最高价氧化物的水化物甲与其气态氢化物化合生成一种盐乙;X、Y、Z、Q四种元素都能与W元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)Q的原子结构示意图为 。
(2)Y和W相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是____(选填字母序号)。
a.常温下,Y的单质呈固态,W的单质呈气态
b.W的气态氢化物的稳定性强于Y的气态氢化物
c.Y与W形成的化合物中,Y呈正价
d.W的最高价氧化物的水化物酸性强于Y的最高价氧化物的水化物
(3)X、Y、W、Q四种元素组成的某无机化合物,受热易分解。写出少量该化合物的溶液与足量的Ca(OH)2溶液反应的离子方程式: 。
(4)常温下,甲、乙的水溶液pH均为5。则甲、乙的水溶液中由水电离出的H+浓度大小关系为:甲____乙(填“>”、“<”或“=”)。
(5)利用原电池原理,将X、Z的单质气体分别通人电池的两极,用质子导电陶瓷传递H+,可合成ZX3,该电池的正极反应式为 。
查看答案和解析>>
科目:高中化学 来源:辽宁省模拟题 题型:填空题
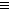 CH
CH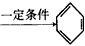 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:__________________。
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有三个氨基,请写出三聚氰胺的结构简式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com