
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再分别滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属小块,观察现象。
①甲同学设计实验的目的是:研究同一周期及同一主族,金属元素的原子_______ 电子能力递变规律。
②实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法__(填字母序号)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
③写出d烧杯中发生反应的离子方程式____________________。
(2)已知元素非金属性越强,其最高价含氧酸的酸性就越强。乙同学设计了下图装置以验证碳、氮、硅元素的原子的非金属性强弱。
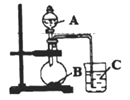
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是一种强酸,常温下可与铜反应;B是块状固体;烧杯中盛放C的溶液。打开分液漏斗的活塞后,可观察到烧杯中有白色沉淀生成。
①写出所选用物质的化学式:A__________、C_________________;
②写出烧杯中发生反应的化学方程式:____________________。
(3)丙同学认为乙同学的实验方案不能达到实验目的,还需采取的改进措施为:_______________。
【答案】 失 BC 2K+2H2O=2K++2OH-+H2↑ HNO3 Na2SiO3或K2SiO3 CO2+H2O+Na2SiO3===H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3===H2SiO3↓+2NaHCO3 在圆底烧瓶和烧杯之间添加一个盛有饱和NaHCO3溶液的洗气瓶
【解析】考查实验方案设计与评价,(1)①上述实验目的:研究同一周期及同一主族,金属原子失去电子能力递变规律;②反应现象不明显,说明反应速率小,升高温度可以加快反应速率,因此把冷水换为热水,把水换成盐酸,增大c(H+),可以加快反应速率,故选项BC正确;③钾是活泼金属,能与水发生反应:2K+2H2O=2KOH+H2↑;(2)①A是一种强酸,常温下可与铜反应,即A为HNO3,验证C、N、Si非金属性,比较其最高价氧化物对应水化物的酸性强弱,酸性越强,其非金属性越强,B为块状固体,即B为CaCO3,C为Na2SiO3或K2SiO3;②利用碳酸的酸性强于硅酸,烧杯中的化学反应方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3或2CO2+2H2O+Na2SiO3=H2SiO3↓+2NaHCO3;(3)HNO3易挥发,挥发出的硝酸与硅酸钠反应,干扰CO2与硅酸钠的反应,因此在圆底烧瓶和烧杯之间添加一个盛有饱和NaHCO3溶液的洗气瓶。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B. 氯化铵与氢氧化钠两种溶液混合加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
C. 钠和冷水反应:Na+2H2O==Na++2OH-+H2↑
D. 向氯化铝溶液中滴加过量氨水:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中应用广泛。回答下列问题:
(1)用新制Cu(OH)2与葡萄糖反应可制备Cu2O,该反应中葡萄糖是___________(填“氧化剂”或“还原剂”)。
(2)用H2O2、H2SO4混合溶液浸泡废铜屑可制备CuSO4,实现“变废为宝”。若将该反应设计成原电池,则正极的电极反应式为________________。
(3)氧化亚铜(CuCl)是微溶于水、易被氧化的白色固体,广泛用作有机合成催化剂、化学分析试剂等。用NH4NO3氧化海绵铜(含Cu和CuO)制备氯化亚铜的部分流程如下:

①步骤Ⅰ中,当0.2molNH4NO3参加反应时,反应中有1mol电子发生转移,则铜参加反应的离子方程式为________________________。
②步骤Ⅱ中充分反应后,分离出产品的方法是_________________。
③步骤Ⅱ中物质X可选用_________________(填字母)
a.SO2 b.Cl2 c.H2O2 d.(NH4)2SO3
该物质需过量的原因之一是加快反应速率,另一原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇. ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1
②CO(g)+2H2(g)CH3OH(g)△H2
将0.20mol CH4(g)和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图.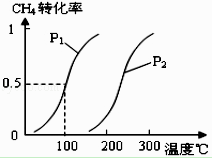
(1)温度不变,缩小体积,增大压强,①的反应速率(填“增大”、“减小”或“不变”),平衡向方向移动.
(2)温度升高,反应①的△H10(填“<”、“=”或“>”),其平衡常数表达式为K= , 100℃时的平衡常数值是 .
(3)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年12约初华北大范围遭受今年以来最严重雾霾,环保监测中心研制中心研判,本次重污染与燃煤污染排放关系最为密切.开发新能源成为当前国际能源研究的重要课题.下列属于新能源的是( ) ①天然气②生物质能③地热能④石油⑤太阳能⑥潮汐能⑦风能⑧氢能.
A.①②③④
B.②③⑤⑥⑦⑧
C.④⑤⑥⑦⑧
D.①②③⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
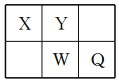
A. Y的最高化合价为+6
B. 简单氢化物的稳定性:Y>W
C. 简单离子半径:W>Q>Y>X
D. X、Y、W不可能同时存在于一种离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2 . 随着SO2的吸收,吸收液的pH不断变化.下列粒子浓度关系一定正确的是( )
A.Na2SO3溶液中存在: ![]()
B.已知NaHSO3溶液pH<7,该溶液中: ![]()
C.当吸收液呈中性时: ![]()
D.当吸收液呈酸性时: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com